
- •Вопрос 1.Основные понятия термодинамики.
- •Вопрос 2. Первое начало термодинамики.
- •Вопрос 3. Второе начало термодинамики.
- •Вопрос 4. Термодинамические условия равновесия.
- •Вопрос 6. Предмет и основные понятия химической кинетики.
- •Вопрос 7. Зависимость скорости реакции от концентрации.
- •Вопрос 8. Зависимость скорости химической реакции от температуры.
- •Вопрос 9. Катализ.
- •Вопрос 10. Кислоты и основания.
- •Вопрос 12. Коллигативные свойства разбавленных растворов неэлектролитов и электролитов.
- •Второй закон Рауля
- •Вопрос 13. Элементы теории растворов электролитов.
- •Вопрос 14. Электрическая проводимость растворов.
- •Вопрос 15. Кондуктометрия. Использование кондуктометрических измерений в медицине и биологии.
- •Вопрос 16. Осмос.
- •Вопрос 17. Растворимость газов в жидкостях и ее зависимость от различных факторов.
- •Вопрос 21. Буферные системы крови: гидрокарбонатная, фосфатная, гемоглобиновая, протеиновая.
- •Белковая буферная система. В сравнении с другими буферными системами имеет меньшее значение для поддержания кислотно-основного равновесия.
- •Гемоглобиновая буферная система.
- •Вопрос 22. Гетерогенные реакции в растворах электролитов.
- •Вопрос 23. Механизм функционирования кальций-фосфатного буфера.
- •Вопрос 24. Строение комплексных соединений.
- •Вопрос 25. Константа нестойкости комплексного иона.
- •Вопрос 26. Представление о строении металлферментов и других биокомплексных соединений.
- •Вопрос 27. Окислительно-восстановительные реакции.
- •Вопрос 28. Константа окислительно-восстановительного процесса.
- •Вопрос 29. Адсорбционные равновесия и процессы на подвижных границах раздела.
- •Вопрос 30. Адсорбционные равновесия на неподвижных границах раздела фаз.
- •Вопрос 31. Классификация дисперсных систем.
- •Вопрос 32. Лигандные, гетерогенные и протолитические равновесия с участием важнейших биогенных элементов (примеры).
- •Вопрос 33. Устойчивость дисперсных систем.
- •Вопрос 34. Свойства растворов вмс.
- •Вопрос 35. Осмотическое давление растворов биополимеров.
- •Вопрос 36. Устойчивость растворов биополимеров.
- •Вопрос 37. Титриметрический анализ.
- •Вопрос 38. Окислительно-восстановительное титрование.
- •Вопрос 39. Комплексонометрическое титрование: комплексонометрия.
- •Вопрос 40. Потенциометрия.
Вопрос 17. Растворимость газов в жидкостях и ее зависимость от различных факторов.
Известно, что всякий газ, приведенный в соприкосновение с жидкостью, будет в ней растворяться. По закону Генри растворимость в жидкостях прямо пропорциональна при данной температуре давлению (при отсутствии химического взаимодействия). Если в жидкости (воде, крови и т.д.) растворяется одновременно несколько газов, то растворение каждого из них происходит независимо друг от друга пропорционально величине его парциального давления в данной газовой среде. Следовательно, растворение газа в жидкости зависит от величины давления газа над жидкостью. Оно будет происходить до тех пор, пока давление газа в жидкости не станет равным его давлению над жидкостью. Кроме того, количество растворенного в жидкости газа и коэффициент растворимости зависят от химической природы газа и его температуры. Коэффициентом растворимости называется количество газа (см3), измеренного при О °С и 760 мм рт.ст., которое может раствориться в 1 см3(1 мл) жидкости при данной температуре.
Растворимость газов зависит также от вида растворителя. Так, например, установлено, что один и тот же газ по-разному растворяется в воде и в масле. Отношение количества газа, растворенного в масле, по отношению к его количеству, растворенному в воде, называется коэффициентом распределения, жиро-водным коэффициентом или по фамилиям авторов установления этой закономерности - овертон-мейеровским коэффициентом. Значение коэффициентов растворимости различных газов и коэффициентов распределения позволяет ориентировочно узнать, как тот или иной газ может раствориться в различных тканях организма человека, находящегося в условиях повышенного давления газовой среды. Растворение газов в жидкостях почти всегда сопровождается выделением теплоты. Поэтому растворимость газов с повышением температуры согласно принципу Ле Шателье понижается.
Генри-Дальтона закон относится к растворимости газов в жидкости в зависимости от упругости этого газа, производящего давление на жидкость. При некотором определенном давлении и постоянной температуре растворяется в жидкости определенное количество газа, зависящее также и от свойств жидкости. При увеличении или уменьшении давления газовой атмосферы на жидкость с сохранением той же температуры увеличивается или уменьшается в таком же отношении количество растворенного газа. Эта зависимость и называется законом Г.-Дальтона;
с (Х) = Kr(X) × P(X)
где с – концентрация газа в насыщенном растворе, моль/л; P(X) – давление газа X над раствором, Па;
Kr(X) – постоянная Генри для газа X, моль×л-1 × Па-1 (константа растворимости газа)
Изучая растворимость газов в жидкостях в присутствии электролитов, русский врач-физиолог И. М. Сеченов (1829—1905) установил следующую закономерность (закон Сеченова): растворимость газов в жидкостях в присутствии электролитов понижается; происходит высаливание газа! Одной из причин уменьшения растворимости газа в присутствии электролита является гидратация ионов электролитов молекулами растворителя, в результате уменьшается число свободных молекул растворителя, т.е. его растворяющая способность.
Значение:изменение растворимости газов в крови при изменении давления могут вызывать тяжелые заболевания.
Кесонная болезнь — болезнь, которой страдают обычно водолазы. Пузырьки газов закупоривают сосуды в различных органах и тканях(эмболия), что может привести к тяжелому поражению тканей и даже гибели человека.
В последнее время при лечении газовой гангрены и ряда других заболеваний, применяют гиперборическая оксигенация, т. е. Помещают больных в барокамеры с повышенным давлением кислорода в воздухе. При этом улучшается снабжение тканей кислородом.
Билет 18. Протолитические реакции.
К протолитическим реакциям относят химические процессы, суть которых заключается в переносе
протона от одних реагирующих веществ к другим.
Протолитическая теория кислот и оснований, в соответствии с которой кислотой считают любое
вещество, отдающее протон, а основанием - вещество, способное присоединять протон, например:
CH3COOH + H2O = CH3COO- + H3O+
кислотаI основаниеI основаниеI кислотаII
NH3 + H2O = NH4+ + OH-
основаниеIкислотаII кислотаII основаниеI
К протолитическим реакциям относят реакции
нейтрализации и гидролиза.
Гидролиз — один из видов химических реакций сольволиза, где при взаимодействии веществ с водой
происходит разложение исходного вещества с образованием новых соединений. Механизм гидролиза
соединений различных классов: соли, углеводы, белки, сложные эфиры, жиры и др. имеет
существенные различия. Гидролиз жиров, белков и углеводов происходит при переваривании пищи, а
при гидролизе АТФ выделяется энергия, обеспечивающая нужды клетки. При гидролизе солей вода
является источником протонов и электронов. Алкалиметрия и ацидиметрия — важнейшие
титриметрические методы определения кислот или же оснований, основанные на реакции
нейтрализации: Н+ + ОН− = Н2О Титрование раствором щелочи называется алкалиметрией, а титрование
раствором кислоты — ацидиметрией
Сила кислот определяется их способностью отдавать протон. Мерой этой способности служит константа кислотности ka. Ka=c(B-)c(H3O+)/c(HB). Чем больше константа кислотности, тем сильнее кислота.
Сила оснований определяется их способностью принимать протон. Kb – константа основности. Kb=с(OH-)c(OB+)/c2(B)
Константа кислотности — константа равновесия реакции диссоциации кислоты на ион водорода и анион кислотного остатка. Константу кислотности можно определить экспериментально по измерению электрической проводимости раствора. Многоосновные кислоты ионизируются ступенчато, и каждая ступень кислотности характеризуется своим значением константы кислотности.
Билет 19. Гидролиз солей. Степень и константа гидролиза.
Гидролизом соли называют взаимодействие соли с молекулами воды, приводящее к образованию малодиссоциированных соединений.
Гидролизу подвергаются соли, являющиеся производными слабых кислот или оснований. Соли, образованные сильными кислотами и основаниями, гидролизу не подвергаются.
1)Гидролиз солей, образованных сильной кислотой и слабым основанием (гидролиз по катиону). Для характеристики полноты протекания реакции используют понятие степень гидролиза (β) – отношение концентрации молекул, подвергшихся гидролизу (С гидр.) к исходной концентрации растворенной соли (С исх.):
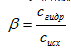 (7.37)
(7.37)
Степень гидролиза зависит от:
Химической природы ионов, составляющих соль;
концентрации соли;
температуры
Степень гидролиза увеличивается с уменьшением константы диссоциации слабой кислоты или основания, уменьшением концентрации соли и повышением температуры.
Гидролиз
протекает в заметной степени только в
разбавленных растворах
![]() ,
тогда следовательно
,
тогда следовательно
![]() ,Это
произведение называется константой
гидролиза (К г):
Константа гидролиза — константа
равновесия гидролитической
реакции.
,Это
произведение называется константой
гидролиза (К г):
Константа гидролиза — константа
равновесия гидролитической
реакции.
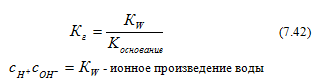
Из выражения (7.42) следует, что уменьшение силы основания ведет к увеличению константы гидролиза, а следовательно, и степени гидролиза.
Степень гидролиза увеличивается с уменьшением силы основания и концентрации соли. Повышение температуры сопровождается увеличением КW, что также ведет к росту β.
2)Гидролиз солей, образованных слабой кислотой и сильным основанием (гидролиз по аниону).
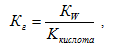 где
К кислота – константа диссоциации
слабой кислоты.
где
К кислота – константа диссоциации
слабой кислоты.
3)Гидролиз солей, образованных слабой кислотой и слабым основанием (гидролиз по аниону и катиону)
Константа гидролиза в этом случае определяется константой диссоциации слабой кислоты и слабого основания:
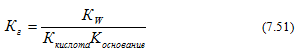
Реакции гидролиза играют важную роль в природных и производственных процессах. В водоочистке для удаления грубодисперсных и коллоидных примесей используют осадки гидроксидов алюминия и железа, получаемые гидролизом сульфатов железа (FeSO4.7H2O; Fe2(SO4)3.9H2O), алюминия Al2(SO4)3.18H2O), или хлорида железа (FeCl3.6H2O). Для обеспечения полноты протекания гидролиза растворы подщелачивают. Важной стадией процесса пищеварения является гидролиз пищи в желудочно-кишечном тракте. Энергия в живых организмах запасается, в основном, в виде АТФ (аденозинтрифосфорная кислота) и выделяется при ее гидролизе.
Билет 20. Буферное действие – основной механизм протолитического гомеостаза в организме.
Кислотно-основными буферными растворами называют такие растворы, рН которых сохраняется примерно постоянным при разбавлении и добавлении кислоты или основания.
Сопряженные кислотно-основные пары В/ВН+ и А-/НА называют буферными системами. В – основание, НА – кислота, ВН+ - сопряженная кислота, А- - сопряженное основание.
В + Н+ = ВН+
НА = Н+ + А-
Буферные растворы играют большую роль в жизнедеятельности. К числу исключительных свойств живых организмов относится их способность поддерживать постоянство рН биологических жидкостей, тканей и органов – кислотно-основной гомеостаз. Это постоянство обусловлено наличием нескольких буферных систем, входящих в состав этих тканей.
Классификация кислотно-буферных систем.
1. Слабая кислота и ее анион А-/НА (ацетатная)
2. Слабое основание и его катион В/ВН+ (аммиачная)
3. Анионы кислой и средней соли или двух кислых солей (например, карбонатная буферная система);
4. Ионы и молекулы амфолитов (аминокислотная, белковая).
Механизм буферного действия.
Буферное действие раствора обусловлено смещением кислотно-основного равновесия за счет связывания добавляемых в раствор ионов Н+ и ОН- в результате реакции этих ионов и компонентов буферной системы с образованием малодиссоциированных продуктов.
Механизм действия буферных систем
1.Разбавление буферной смеси водой.
Из уравнения Гендерсона-Гассельбаха следует, что рН буферной смеси зависит только от соотношения компонентов и не зависит от концентраций. При разведении системы водой увеличивается ее объем, количества кислоты и соли остаются прежним
pH=pKa+lgС(соль)/С(кислота)
2.Постоянство реакции среды при добавлении кислот и оснований.
Системы противостоят изменению рН среды за счет своих кислотных или основных резервов. Протоны добавленной кислоты будут связываться с основаниями ,а гидроксид-анионы добавленного основания с кислотой буферной системы
Пример: Фосфатная буферная система (Na2HPO4, NaH2PO4)
В растворе в результате диссоциации присутствуют анионы кислоты- Н2РО4- и сопряженного основания- НРО42-.Добавим небольшое количество сильной кислоты(HCl, H2SO4). Сдвига рН среды практически не будет наблюдаться, так как с кислотой будет реагировать щелочь , образуя слабо диссоциирующий электролит Н2РО4-
Н+ + НРО42- ↔ Н2РО4-
НСl + Na2HPO4 ↔ NaCl + NaH2PO4
В результате реакции вместо сильной кислоты появилось эквивалентное количество слабой кислоты, поэтому рН раствора существенно не меняется.
Аналогично ведет себя система при добавление небольших количеств щелочи. В этом случае в реакцию вступает кислотный резер системы – ионы Н2РО4-
OH- + H2PO4- ↔ HPO42- + H2O
HCl + NaH2PO4 ↔Na2HPO4 + H2O
Уравнение Гендерсона-Гассельбаха. pH=pKa+lgС(сопряженное основание)/С(кислота)
pH=14-(pKв+lgСсопряженное основание/Скислота)
рН любой буферной смеси будет зависеть отприроды взятых компонентов, т.е от константы диссоциации слабой кислоты или слабого основания, а так же от соотношения концентраций компонентов буферной смеси. С(соль)С(основ.)или (кислота) или в соответствии с протолитической теорией С(сопряженное основание)С(кислота)
Расчет рН буферных систем.
Уравнение Гендерсона-Гассельбаха
для буф. систем 1ого типа:
рН = рКа + lg (c(соль)/c(кислота) )
для 2ого типа систем:
рН = рКа + lg (c(основание)/c(соль) )
для 3его типа:
рН = рКа(кислоты) + lg (c(соль)/c(кислота) )
Величину, характеризующую способность буферного раствора противодействовать смещению реакции среды при добавлении кислот и щелочей, называют буферной емкостью раствора. Она измеряется количеством кислоты или щелочи (моль или моль эквивалента), добавление которого к 1 л буферного раствора изменяет рН на единицу.
Буферная емкость, как следует из ее определения, зависит от ряда факторов:
1. Чем больше количества компонентов кислотно-основной пары основание/ сопряженная кислота в растворе, тем выше буферная емкость этого раствора (следствие закона эквивалентов).
2. Буферная емкость зависит от соотношения концентраций компонентов буферного раствора, а следовательно, и от рН буферного раствора.
 Способность
противодействовать изменению рН при
добавлении кислот и щелочей, имеет
протяжность приблизительно одну единицу
рН с каждой стороны от точки рН=рКа. Вне
этого интервала буферная емкость быстро
падает до 0. Интервал рН=рКа +/-
1 называется
зоной буферного
действия.
Способность
противодействовать изменению рН при
добавлении кислот и щелочей, имеет
протяжность приблизительно одну единицу
рН с каждой стороны от точки рН=рКа. Вне
этого интервала буферная емкость быстро
падает до 0. Интервал рН=рКа +/-
1 называется
зоной буферного
действия.
