
- •Вопрос 1.Основные понятия термодинамики.
- •Вопрос 2. Первое начало термодинамики.
- •Вопрос 3. Второе начало термодинамики.
- •Вопрос 4. Термодинамические условия равновесия.
- •Вопрос 6. Предмет и основные понятия химической кинетики.
- •Вопрос 7. Зависимость скорости реакции от концентрации.
- •Вопрос 8. Зависимость скорости химической реакции от температуры.
- •Вопрос 9. Катализ.
- •Вопрос 10. Кислоты и основания.
- •Вопрос 12. Коллигативные свойства разбавленных растворов неэлектролитов и электролитов.
- •Второй закон Рауля
- •Вопрос 13. Элементы теории растворов электролитов.
- •Вопрос 14. Электрическая проводимость растворов.
- •Вопрос 15. Кондуктометрия. Использование кондуктометрических измерений в медицине и биологии.
- •Вопрос 16. Осмос.
- •Вопрос 17. Растворимость газов в жидкостях и ее зависимость от различных факторов.
- •Вопрос 21. Буферные системы крови: гидрокарбонатная, фосфатная, гемоглобиновая, протеиновая.
- •Белковая буферная система. В сравнении с другими буферными системами имеет меньшее значение для поддержания кислотно-основного равновесия.
- •Гемоглобиновая буферная система.
- •Вопрос 22. Гетерогенные реакции в растворах электролитов.
- •Вопрос 23. Механизм функционирования кальций-фосфатного буфера.
- •Вопрос 24. Строение комплексных соединений.
- •Вопрос 25. Константа нестойкости комплексного иона.
- •Вопрос 26. Представление о строении металлферментов и других биокомплексных соединений.
- •Вопрос 27. Окислительно-восстановительные реакции.
- •Вопрос 28. Константа окислительно-восстановительного процесса.
- •Вопрос 29. Адсорбционные равновесия и процессы на подвижных границах раздела.
- •Вопрос 30. Адсорбционные равновесия на неподвижных границах раздела фаз.
- •Вопрос 31. Классификация дисперсных систем.
- •Вопрос 32. Лигандные, гетерогенные и протолитические равновесия с участием важнейших биогенных элементов (примеры).
- •Вопрос 33. Устойчивость дисперсных систем.
- •Вопрос 34. Свойства растворов вмс.
- •Вопрос 35. Осмотическое давление растворов биополимеров.
- •Вопрос 36. Устойчивость растворов биополимеров.
- •Вопрос 37. Титриметрический анализ.
- •Вопрос 38. Окислительно-восстановительное титрование.
- •Вопрос 39. Комплексонометрическое титрование: комплексонометрия.
- •Вопрос 40. Потенциометрия.
Вопрос 7. Зависимость скорости реакции от концентрации.
Закон действующих масс (Гультберг, Вааге):
Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ в степенях их стехиометрических коэффициентов.
П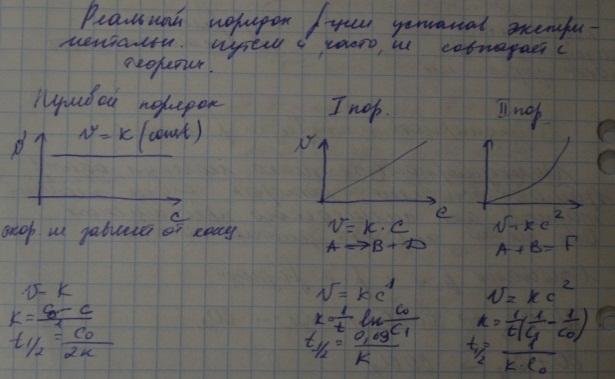 орядок
реакции определяет характер зависимости
скорости реакции от концентрации
реагирующих веществ. И зная порядок
реакции, можно сделать некоторые
предположения о механизме ее протекания.
орядок
реакции определяет характер зависимости
скорости реакции от концентрации
реагирующих веществ. И зная порядок
реакции, можно сделать некоторые
предположения о механизме ее протекания.
О
V=kCaA*CbB
k – константа скорости химической реакции (отвечает за природу химических веществ, агрегатное состояние)
С – молярная концентрация
Зависимость скорости химической реакции от концентрации описывается кинетическим уравнением. Например для реакции:
 aA
+ bB
продукты
aA
+ bB
продукты
V=kc(A)в степени p * c(B) в степени q
Где p,q – найденные экспериментальным путем коэффициенты
k-константа скорости реакции, размерность которой зависит от значений p,q
C-концентрации реагентов А и В
a, b – стехиометрические коэффициенты
Реакции нулевого порядка:
-dc/dt =k откуда С0 – Сt =kt
По нулевому порядку проходят следующие процессы:
-фотохимические реакции, скорость которых определяется количеством поглощенного света.
- каталитические реакции, скорость которых зависит от концентрации только катализатора
-реакции, в которых убыль исходного вещества постоянно восполняется его поступлением из другой фазы.
Прямая идет параллельно оси абсцисс, tg( альфа )=0, т.е. p + q =0
V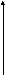

 C
C
![]() (II.5)
(II.5)
Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ; это характерно для многих гетерогенных (идущих на поверхности раздела фаз) реакций в том случае, когда скорость диффузии реагентов к поверхности меньше скорости их химического превращения.
Реакции первого порядка: в том случае если угол наклона прямой на графике составляет 45 градусов, tg= 1
-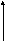
 dc/dt=kc
dc/dt=kc
v
c
Реакции первого порядка характеризуются кинетическим уравнением вида V=K1Ca= -DT/DC. После интегрирования выражения lnC= -KT+g Константу интегрирования g определим из начальных условий: в момент времени t = 0 концентрация С равна начальной концентрации Со. Отсюда следует, что g = ln Со.
Ln C= ln Co -KT
K=1/t + ln Co/C
Реакции второго порядка:
-dc/dt=kt(в квадрате)
График – кривая.
Для реакций второго порядка кинетическое уравнение имеет следующий вид V=K*Ca*Cв= -DT/DC, после интегрирования 1/С=KT+1/Co
Для экспериментального измерения скорости химических реакций необходимо иметь данные о количестве или концентрации участвующих в реакции веществ в различные моменты времени. Экспериментальные методы подразделяются на химические, физические и биохимические в зависимости от способа измерения количества вещества или его концентрации в ходе реакции.
Вопрос 8. Зависимость скорости химической реакции от температуры.
Влияние температуры на скорость химической реакции.
В 1884 г. Я.Г. Вант-Гофф эмпирически установил правило, согласно которому при повышении температуры на каждые 10°С скорость химической реакции увеличивается в 2-4 раза. Это правило может быть использовано для приблизительной характеристики влияния температуры на скорость химической реакции в небольшом интервале температур.
Правило Вант-Гоффа: скорость большинства реакций увеличивается приблизительно в 2-4 раза при увеличении температуры на 100С: Vt2=Vt1*γt2-t1/10, где γ – температурный коэффициент константы скорости реакции.
Уравнение Аррениуса для константы скорости: устанавливает зависимость константы скорости химической реакции
 от температуры
от температуры 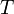 .
d*lnKр/dT
= А*e(-E/RT)
k=Ae-Ea/RT,
где Еа
(энергия
активации Дж/моль) и А (предэкспонента)
– постоянные, не зависящие от температуры
величины, R
– универсальная газовая постоянная,
Т – абсолютная температура.
.
d*lnKр/dT
= А*e(-E/RT)
k=Ae-Ea/RT,
где Еа
(энергия
активации Дж/моль) и А (предэкспонента)
– постоянные, не зависящие от температуры
величины, R
– универсальная газовая постоянная,
Т – абсолютная температура.
Уравнение, которое часто используют для различных расчетов, получают путем неопределенного интегрирования : k=А*e(-E/RT), где k – константа (моль*л/сек), А – предэкспотенциальный множитель, где Еа - энергия активации (Дж/моль).
Через скорость:
υ2/υ1= γ(t2 - t1) / 10
Например, известно, что при нагревании газа с 30° до 60° С скорость реакции увеличилась в 8 раз. Следовательно, согласно правилу Вант-Гоффа
8 = γ(60 - 30) /10= γ3; γ = 2.
правило Вант-Гоффа применимо только для реакций с энергией активации 60-120 кДж/моль в температурном диапазоне 10-400oC. Правилу Вант-Гоффа также не подчиняются реакции, в которых принимают участие громоздкие молекулы, например, белки в биологических системах. Но кинетическая теория не в состоянии объяснить причину быстрого роста скорости химической реакции с повышением температуры, так как не каждое соударение молекул приводит к взаимодействию. В связи с этим кинетические представления были пополнены теорией активации.
Энергия активации(Е, [Дж/моль]) - это минимальная энергия, которой должны обладать реагирующие частицы, чтобы столкновения между ними приводили к химическому взаимодействию.
Теория активных соударений (Аррениус):
Реакционноспособными являются не все молекулы, а только те, которые находятся в особом активном состоянии.
Активные молекулы образуются из обычных в результате протекания обратимого процесса поглощения энергии.
Активные молекулы превращаются в молекулы конечного продукта со скоростью, не зависящей от температуры.
Влияние температуры на скорость химического процесса сводится к смещению равновесия между обычными и активными молекулами в сторону увеличения концентрации последних.
Стерические факторы— пространственные затруднения (реже пространственные содействия) химическому взаимодействию двух реагирующих веществ, возникающих вследствие появления объёмистых заместителей вокруг реакционного центра или создания вокруг него таких структурных образований (из молекул белков, липидов и т. д.), которые одним реагентам закрывают, а другим открывают доступ к реакционному центру.
Особенно важна роль стерических факторов в биохимических процессах, а также в химии полимеров.
Суть теории переходного состояния (активированного комплекса):
1)частицы реагентов при взаимодействии теряют свою кинетическую энергию, которая превращается в потенциальную, и для того чтобы реакция свершилась, необходимо преодолеть некий барьер потенциальной энергии; 2) разница между потенциальной энергией частиц и упомянутым энергетическим барьером и есть энергия активации; 3) переходное состояние находится в равновесии с реагентами; 4) в тех реакциях, где энергия активации существенно ниже энергии разрыва химических связей, процессы образования новых связей и разрушения старых связей могут полностью или частично совпадать по времени.
