
- •Тема 1. Элементы квантовой механики
- •Корпускулярно-волновые свойства света.
- •1.2 Соотношения неопределенностей Гейзенберга.
- •1.3.Волновое уравнение частицы.
- •1.4. Движение частиц через потенциальный барьер. Туннельный эффект.
- •1.5 Линейный гармонический осциллятор.
- •1.6 Электрон в атоме водорода
- •Тема 2. Кристаллические решётки
- •2.1 Структура и виды кристаллических решёток, их характеристики.
- •2.2 Дефекты реальных кристаллических материалов их влияние на свойства твердых тел.
- •Тема 3. Элементы зонной теории твердых тел
- •3.1.Обобществление электронов в кристалле. Зонный характер энергетического спектра электронов в кристалле.
- •Ядра соседних атомов, притягивая электрон, ослабляют его связь
- •В результате взаимодействия одни уровни смещаются вверх,
- •3.2. Зоны Бриллюэна. Число уровней в разрешённых зонах. Заполнение зон электронами и электрические свойства твердых тел
- •3.3. Зонные диаграммы металлов, полупроводников и диэлектриков.
- •3.3. Статистика электронов и дырок в полупроводниках
- •Тема 4. Статистика носителей зарядов в полупроводниках и металлах
- •4.1.Основные понятия статистической физики.
- •4.2 Микрочастицы и макроскопические системы . Термодинамическое и статистическое описание идеального электронного газа.
- •4.3. Концентрация электронов и дырок в собственном полупроводнике
- •4.4. Концентрация электронов и дырок в примесном полупроводнике
- •Определение положения уровня Ферми
- •4.5.Неравновесные носители
- •Тема 5. Электропроводность твердых тел
- •5.1 Тепловое движение и его средняя скорость.
- •5.3 Дрейфовый ток
- •5.4.Диффузионный ток
- •Эффект Холла
- •5.6.Эффект Ганна.
- •Тема 6.Поверхностные явления в полупроводниках
- •Тема 7. Контактные явления и электрические переходы
- •7.1 Работа выхода электронов из металла и полупроводника.
- •7.2 Контакт металл-металл. Контактная разность потенциалов.
- •7.3.Термоэлектрические явления
- •7.4.Контакт металл-полупроводник: выпрямляющий (барьер Шотки) и невыпрямляющий (омический) контакты
- •7.6. Прямое включение p-n-перехода.
- •7.7. Обратное включение p-n-перехода.
- •7.8 Инжекция неосновных носителей
- •7.9. Вольт-амперная характеристика идеального р - n перехода
- •7.10 Отличие вольт-амперной характеристики р-n перехода от теоретической
- •7.11.Туннельный эффект в электронно-дырочном переходе.
- •Тема 8. Физические основы оптоэлектроники и квантовой электроники 4 часа
- •8.1.Основные понятия фотометрии. Основные энергетические и фотометрические величины.
- •8.2.Фотопроводимость полупроводников.
- •8.3.Фотоэлектрические эффекты в p-n-переходе. Влияние светового потока на вах p-n-перехода.
- •8.4. Основные виды генерации оптического излучения в полупроводниках:
- •8.6. Внешняя квантовая эффективность
- •8.7.Энергетические спектры атомов, молекул и твердых тел.
- •8.8.Спектральные свойства активной среды. Ширина спектральной линии, причины ее уширения.
- •8.10.Методы создания инверсии населенностей.
- •Тема 9. Физические основы вакуумной и плазменной электроники
- •9.2 Типы эмиссии:
- •9.3 Термоэлектронные катоды
- •9.7.Токопрохождение в вакууме. Конвекционный, наведенный и полный ток.
- •9.8 Электрический разряд в газах. Возбуждение и ионизация атомов газа.
- •1.2. Задачи
- •Пример решения
- •2. Статистика носителей зарядов в полупроводниках и металлах 4 часа
- •2.1. Краткие теоретические сведения
- •2.2 Задачи для решения
- •3.1. Краткие теоретические сведения
- •3.2. Задачи
- •3.3. Примеры решения задач
- •4. Поглощение и излучение света 4 часа
- •4.2 Задачи
- •4.3 Примеры решения задач
1.2 Соотношения неопределенностей Гейзенберга.
В 1927 году Вернер Гейзенберг, анализируя возможность измерения координаты импульса электрона, пришёл к заключению, что условия, благоприятные для измерения положения, затрудняют нахождение импульса, и наоборот. Эти два понятия дополнительны друг другу. Для доказательства он ставил мысленные эксперименты: чтобы определить координату электрона, нужно осветить его и посмотреть в «микроскоп». Такой способ даёт неопределённость координаты ∆q порядка длины волны λ использованного света ∆q~ λ.
Для уточнения положения электрона надо брать возможно меньшую длину волны света. Но при взаимодействии с электроном свет передаёт ему импульс, который растёт при уменьшении длины волны Минимальный передаваемый электрону импульс будет порядка импульса одного фотона, а импульс фотона связан с его длиной волны соотношением: p=2π h/λ (здесь - постоянная Планка), поэтому неопределённость импульса электрона должна быть больше чем 2 π h/λ .Проведя необходимые преобразования, получаем соотношение неопределённости Гейзенберга ∆q ∆ p больше 2 πћ.
Проделав множество подобных мысленных экспериментов с тем же результатом, нельзя не прийти к заключению, что здесь речь идёт о принципиальном ограничении, которое природа накладывает на понятия координаты и импульса частицы. Этого ограничения не знала классическая физика, оно не вносит изменения в описание макрообъектов из-за очень малой величины постоянной Планка ћ=1.05 10-34Дж с.
В квантовой механике принцип неопределённости Гейзенбе́рга (или Га́йзенберга) устанавливает, что, поскольку любое измерение изменяет состояние каждой частицы, при одном измерении нельзя одновременно измерить значения и координаты и импульса. Для ансамбля частиц уменьшение дисперсии при измерении физической величины приводит к увеличению дисперсии сопряжённой физической величины. Считается, что принцип неопределённости связан не только с возможностями экспериментальной техники, но и показывает фундаментальное свойство природы и что существует ненулевой предел для произведения дисперсий сопряжённых пар физических величин, характеризующих состояние системы. Принцип неопределённости обнаруживается также в классической теории измерений физических величин.
Обычно
принцип неопределённости иллюстрируется
следующим образом. Рассмотрим ансамбль
невзаимодействующих эквивалентных
частиц, для каждой из которых измеряется
либо координата
q,
либо импульс
p.
При этом результаты измерений будут
случайными величинами, среднеквадратические
отклонения
которых от средних значений будут
удовлетворять соотношению
неопределённостей
![]() ,
где
,
где
![]() –
постоянная
Дирака.
–
постоянная
Дирака.
1.3.Волновое уравнение частицы.
Любая волна описывается особым типом уравнений — волновыми уравнениями. Все без исключения волны — волны океана, сейсмические волны горных пород, радиоволны из далеких галактик — описываются однотипными волновыми уравнениями.
Для описания частицы Шрёдингер применил классическое дифференциальное уравнение волновой функции и получил уравнение, которое описывает распространение волны вероятности нахождения частицы в заданной точке пространства подобно тому как обычное уравнение волновой функции описывает распространение, например, ряби по поверхности воды,.
Пики этой волны (точки максимальной вероятности) показывают, в каком месте пространства скорее всего окажется частица.
Волновая функция распределения вероятности, обозначаемая греческой буквой ψ («пси»), является решением следующего дифференциального уравнения, это уравнение свидетельствует о том, что вероятность ведёт себя как волна:
![]() (1.3)
(1.3)
где h — постоянная Планка, а m, E и U — соответственно масса, полная энергия и потенциальная энергия частицы.
Картина квантовых событий, которую дает нам уравнение Шрёдингера, заключается в том, что электроны и другие элементарные частицы ведут себя подобно волнам на поверхности океана. С течением времени пик волны (соответствующий месту, в котором скорее всего будет находиться электрон) смещается в пространстве в соответствии с описывающим эту волну уравнением. То есть то, что мы традиционно считали частицей, в квантовом мире ведёт себя во многом подобно волне.
В общем случае в задачах квантовой механики дифференциальное уравнение в частных производных должно решаться с учетом определенных начальных и граничных условий на волновую функцию.
Начальное
условие задает значение волновой функции
в начальный момент времени
![]() .
.
Уравнение Шредингера, как и законы классической механики Ньютона, законы термодинамики, уравнения электродинамики Максвелла и другие основные физические уравнения, не может быть выведено из других соотношений. Его следует рассматривать как некоторое научное положение, справедливость которого доказывается согласием результатов расчетов, выполненных с помощью уравнения Шредингера, с данными экспериментов. Такое согласие установлено для большого числа явлений в атомной и ядерной физике. Квантовые эффекты, предсказанные с помощью уравнения Шредингера, лежат в основе многих технических устройств, приборов и технологий.
Уравнение
Шредингера тесно связано с гипотезой
де Бройля и вытекающим из неё
корпускулярно-волновым дуализмом
материи. Действительно, непосредственной
проверкой легко убедиться, что для
свободной частицы, с кинетической
энергий
![]() ,
движущейся в отсутствие силовых полей
(
,
движущейся в отсутствие силовых полей
(![]() )
в направлении оси
)
в направлении оси
![]() ,
решением соответствующего уравнения
Шредингера
,
решением соответствующего уравнения
Шредингера
|
|
(1.4) |
является волновая функция
-
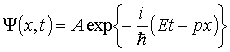
(1.5)
соответствующая плоской волне де Бройля. Этот факт позволяет утверждать, что и в общем случае уравнение Шредингера является волновым уравнением.
Неопределенность установления положения и скорости электрона столь велика, что необходимо вообще отказаться от анализа траектории его движения. Однако есть возможность вероятностного описания строения атома.
Решением уравнения Шредингера является волновая функция ψ и соответствующее ей значение энергии электрона E.
Вероятность нахождения электрона в пространстве характеризуется квадратом волновой функции, т.е. величиной ψ2.
Для описания строения атома можно рассматривать электрон “размазанным” в пространстве в виде электронного облака. Величина ψ2, полученная из волнового уравнения, является мерой электронной плотности в данном элементе объема, или мерой вероятности нахождения электрона в данном элементе объема атома.
Таким образом, в квантовомеханической (вероятностной) модели атома исчезает смысл орбиты, на которой находится электрон. Взамен ее мы имеем дело с электронной плотностью, “размазанной” в пространстве атома.
Тело, образованное “размазанным” электроном, называют орбиталью. Обычно под орбиталью понимают часть пространства, заключающую 90% электронного облака.
Наличие трех измерений пространства приводит к тому, что в выражении волновой функции ψ, являющейся решением уравнения Шредингера, появляются три величины, которые могут принимать только дискретные целочисленные значения – три квантовых числа. Они обозначаются символами n, l и ml. Эти квантовые числа характеризуют состояние электрона не только в атоме водорода, но и в любом другом атоме.
а) Главное квантовое число (n) определяет средний радиус электронного облака, или общую энергию электрона на данном уровне. Оно принимает натуральные значения от 1 до . В реальных атомах n имеет 7 значений, обозначаемых латинскими буквами K, L, M, N, O, P, Q. Значение n=1 отвечает уровню с самой низкой энергией (т.е. наиболее устойчивому состоянию электрона). Теоретически количество уровней не ограничено, но в атоме главным образом бывают заняты электронами уровни с низкой энергией.
б) Побочное, или орбитальное, квантовое число (l). В спектрах многоэлектронных атомов наблюдается мультиплетная структура линий, т.е. линии расщеплены на несколько компонент. Мультиплетность линий означает, что энергетические уровни представляют собой совокупности энергетических подуровней, т.к. любой линии в спектре отвечает переход электрона из одного состояния в другое. Энергетические различия в состоянии электронов в данном уровне связаны с различием в форме электронных облаков.
Для характеристики энергетических подуровней используется орбитальное квантовое число l.
Оно может принимать в пределах каждого уровня целочисленные значения от 0 до n–1. Таким образом, уровень в зависимости от l подразделяется на подуровни, которые имеют также буквенные обозначения: s (l=0), p (l=1), d (l=2), f (l=3). Электроны, находящиеся в этих состояниях, называются s-, p-, d- и f-электронами.
в) Магнитное квантовое число (ml). Если атом поместить во внешнее магнитное поле, то происходит дальнейшее расщепление спектральных линий. Это означает, что при данных значениях n и l может существовать несколько состояний электрона с одинаковой энергией. Такие энергетические состояния называются вырожденными. Вырождение исчезает при воздействии на атом внешнего магнитного поля, что и приводит к появлению новых линий в спектре. Магнитное квантовое число ml для данного подуровня – это целочисленная величина в диапазоне от –l до +l. Таким образом, при данном l m имеет (2l+1) различных значений для различной ориентации электронного облака по отношению к силовым линиям магнитного поля.
