
- •Введение
- •Раздел1 Физико-химические основы материаловедения.
- •Тема1.1.Строение и кристаллизация металлов.
- •Анизотропия
- •Кристаллическое строение реальных кристаллов.
- •Аллотропия
- •Кристаллизация металлов
- •Модифицирование.
- •Методы металографического и физико-химического анализа металлов. Макроанализ.
- •Микроанализ.
- •Рентгеновский анализ.
- •Дефектоскопия.
- •Тема1.2Пластическая деформация и рекристаллизация.
- •Влияние нагрева на структуру и свойства деформированного металла.
- •Тема1.3Механические свойства материалов.
- •Испытание на растяжение:
- •. Метод Бринелля:
- •Метод Роквелла
- •Метод Виккерса
- •Испытание на ударную вязкость.
- •Тема1.4Основные понятия о сплавах.
- •Диаграммы состояния двойных сплавов
- •Диаграммы состояния сплавов первого рода
- •Диаграмма состояния сплавов второго рода
- •Тема1.5 Основы металлургического производства. .Производство чугуна
- •Производств стали.
- •Конверторный способ:
- •Мартеновский способ:
- •Производство стали в электрических печах
- •Разливка стали и строение слитка
- •Тема1.6Железоуглеродистые сплавы. Диаграмма Fe- Fe3c.
- •Кристаллизация чугунов.
- •Кристаллизация сталей.
- •Тема1.6Углеродистые стали , чугуны. Чугуны
- •Серый чугун( гост 1412—79)
- •.Модифицированный чугун
- •Высокопрочный чугун(7293-85)
- •Ковкий чугун(1215-79)
- •Легированные чугуны
- •Углеростые стали. Классификация углеродистых сталей.
- •Влияние углерода и примесей на свойства стали.
- •Конструкционная сталь обыкновенного качества.(гост380-71)
- •Качественные углеродистые стали (гост 1050—74)
- •Рессорно-пружинная сталь(гост14959-79)
- •Автоматная сталь(гост1414-75)
- •Углеродистые инструментальные стали ( гост 1435—74)
- •Тема1.8 Термическая обработка.Стали и чугуна.
- •Превращения в стали при нагреве
- •Превращение переохлажденного аустенита
- •Превращения в закаленной стали при нагреве
- •Термическое и деформационное старение углеродистой стали
- •Нормализация
- •Закалка.
- •Способы закалки
- •. Отпуск
- •Старение
- •Обработка стали холодом
- •Термомеханическая обработка стали
- •Тема1.9 Химико – термическая обработка.
- •Цементация
- •3)Жидкостная цементация.
- •Азотирование
- •Сульфоцианирование
- •Диффузионная металлизация.
- •Алитирование
- •Хромирование
- •Силицирование
- •Борирование
- •Раздел 2Конструкционные и инструментальные материалы.
- •Тема2.1Общие свойства легированных сталей..
- •Классификация легированных сталей по структуре
- •1.Влияние легирующих элементов на аллотропические превращения в железе.
- •Влияние легирующих элементов на карбидную фазу.
- •Влияние легирующих элементов:
- •Тема2.2 Конструкционные стали. Конструкционные (строительные) низколегированные стали (гост 19281—73).
- •Конструкционные цементуемые (нитроцементуемые) стали (гост 4543—71)
- •Конструкционные улучшаемые стали(гост 4543—71).
- •Мартенситно-стареющие высокопрочные стали
- •Рессорно-пружинные стали (гост 14959—79);.
- •Шарикоподшипниковые стали(гост 801—78).
- •Износостойкая (аустенитная) сталь
- •Тема2.3Стали и сплавы с особыми свойствами. Коррозионностойкие.Нержавеющие стали. (гост 5632—72)
- •Жаропрочные и окалиностойкие стали. Жаропрочность.
- •Окалиностойкость (жаростойкость)
- •Жаропрочные и окалиностойкие стали
- •Клапанные стали(гост 5632—72)
- •Котлотурбинные стали
- •Жаропрочные стали и сплавы для газовых турбин
- •Никелевые жаропрочные сплавы
- •Дисперсно упрочненные никелевые жаропрочные сплавы
- •Сплавы с высоким электрическим сопротивлением(гост 12766—67)
- •Сплавы с особыми тепловыми и упругими свойствами
- •Магнитные стали и сплавы
- •Магнитно-твердые стали и сплавы
- •Тема2.4 Инструментальлые стали
- •Стали неглубокой прокаливаемости
- •Стали глубокой прокаливаемости
- •Быстрорежущие стали(гост 19265—73)
- •Штамповые стали
- •Теплостойкие штамповые стали
- •Стали для измерительных инструментов
- •Тема2.5Твердые сплавы (гост 3882—74) и свехтвердые режущие материалы.
- •Тема2.6 Цветные металлы и сплавы. Медь и ее сплавы.
- •Латуни(Гост 17711—80)
- •Алюминий и его сплавы
- •Классификация алюминиевых сплавов
- •Термическая обработка алюминиевых сплавов Отжиг
- •Закалка
- •Старение
- •Деформируемые не упрочняемые термической обработкой.
- •Литейные алюминиевые сплавы.
- •Магний и его сплавы. (гост804-72)
- •.Титан и его сплавы.
- •Термическая обработка титановых сплавов
- •Подшипниковые сплавы.
- •Тема2.7Коррозия металлов. Классификация и виды коррозии.
- •Защита металлов от коррозии.
- •Раздел3 Неметаллические материалы.
- •Тема3.1 Пластические массы.
- •Слоистые пластмассы
- •Термопластические полимерные материалы
- •Переработка пластмасс
- •Пенопласты
- •Тема3.2Резина, резинотехнические изделия. Исходное сырье. Каучук
- •Основные виды резины и их назначение
- •Тема3.3 Клеи,герметики,и лакокрасочные материалы. Виды лакокрасочных материалов
- •Радел 4 Порошковые и композиционные материалы,их получение.
- •Тема 4.1 Порошковая металлургия.
- •Тема4.2Композиционные материалы с полимерной матрицей.
- •Волокнистые композиционные материалы с полимерной матрицей
- •Углепласты.(карбоволокниты)
- •Углерод- углеродный материал.
- •Боропласты(бооволокниты).
- •Органоволокниты.
- •Дисперсно-упрочненные композиционные материалы
- •Тема4.3Композиционные материалы с металлической матрицей
Тема2.7Коррозия металлов. Классификация и виды коррозии.
Взаимодействие с окружающей средой, вызывающее разрушение металлов, называется коррозией, а среда, в которой происходит процесс коррозии, называется коррозионной, или агрессивной.
По механизму процесса различают химическую и электрохимическую коррозию. Химическая коррозия — процесс разрушения металла при его взаимодействии с внешней средой, не проводящей электрический ток, а электрохимическая — при взаимодействии с электропроводящими жидкостями — электролитами.
По характеру (типу) разрушения различают коррозию сплошную (общую), местную, избирательную, с механическим воздействием.
Сплошная коррозия может быть равномерной, протекающей с одинаковой скоростью по, всей поверхности, и неравномерной, скорость которой неодинакова на различных участках поверхности металла.
Местная коррозия характеризуется очагами разрушения на поверхности металла и подразделяется на пятнистую, язвенную, точечную, подповерхностную избирательа.ую, межкр исталлитную, внутрикристаллитную.
Избирательная коррозия проявляется в том, что действует на определенные химические элементы или на фазы многофазных сплавов. Так, в серых чугунах корродируют феррит и перлит, а графитный каркас сохраняется; в латунях происходит обеднение цинком (обесцинкование) с образованием на поверхности изделий губчатого медного осадка.
Образование на поверхности металла коррозионных пятен малой глубины характеризует пятнистую коррозию, большой глубины — язвенную. Первая наблюдается, например, при коррозии латуни в морской воде, вторая — при коррозии стали в грунте.
Точечная коррозия (питтинг) характеризуется образованием тонких кратеровидных, вплоть до сквозных, углублений. Точечной коррозии подвергается нержавеющая сталь в морской воде.
При межкристаллитной коррозии растворяются границы зерен, что может привести к внезапному катастрофическому разрушению сооружений, как и коррозионное растрескивание (внутрикристаллитная коррозия), происходящее по объему зерен
Когда разрушение начинается под слоем защитного покрЫтия (лак, пленки и др.), продукты коррозии сосредоточиваются внутри металла — это подповерхностная коррозия, весьма опасный вид, результатом его является вспучивание и расслоение металла.
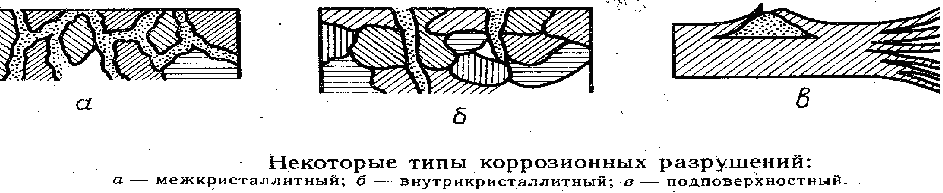
Интенсивно протекает коррозия под действием напряжений
(при статическом и циклическом приложении нагрузки, вибрациях, истираний). Зарождение и развитие трещий в этом случает идет по структурным элементам, и разрушение носит интеркристаллитный.(по границам зерен) или транскристаллитный (по телу зерен) характер Очаги зарождения разрушения обнаруживаются лишь при микроанализе.
Наименее опасна общая коррозия. Местная коррозия, как и под действием напряжений, гораздо опаснее: при неизменном внешнем виде конструкции ее прочность значительно снижена (за счет трещiн) и возрастает опасность разрушения.
Химическая и электрохимическая коррозия
Химическая коррозия. Самый распространенный вид химической коррозии — газовая — наблюдается при работе арматуры нагревательных печей, в котлах и турбинах, в двигателях внутреннего сгорания, в соплах реактивных двигателей и т. д. Газовая коррозия протекает интенсивнее с ростом температуры, так как растет скорость диффузии газов через пленку оксида к металлу и встречной диффузии атомов металла. В случае образования не очень плотной пленки сернистый и другие агрессивные газы могут резко ускорить коррозию. При образовании прочных плотных пленок коррозия замедляется.
Углеродистые стали, Тi, Та, W—Со — твердые сплавы легко корродируют при температурах выше 500...600 °С, а стали, легированные Сг,Ni, А1, окисляясь с образованием оксидной пленки сложного состава, хорошо сопротивляются коррозии до 850. ..900 °С.
.Электрохимическая коррозия. Металлические емкости, детали машин и конструкций, работающие в контакте с растворами щелочей, солей, кислот, в морской и речной воде, во влажной атмосфере и т. д., подвергаются электрохимической коррозии.
Если в контакте с электролитом находятся два металла, то механизм коррозии подобен работе гальванической пары: металл с более отрицательным потенциалом (анод) непрерывно растворяется, а с менее отрицательным (катод) восстанавливается Для оценки коррозионной стойкости металлов определяют значения их электродных потенциалов относительно водородного, условно принятого за нуль. Электродные потенциалы металлов могут быть как больше, так и меньше, чем у водорода. В порядке убывания электрохимического потенциала металлы располагаются так: Аu, Аg,
Сu, Вi, Sb, РЬ, Sn,Ni и т.д.
При атмосферной коррозии электролитом служит сконденсировавшаяся на поверхности металла влага, агрессивность которой повышается при загрязнении ее газами СО2, SO2, угольной пылью и др.
Все увеличивающаяся протяженность трубопроводов (нефтяных, газовых, водных) приводит к росту вклада почвенной (подземной) коррозии. Имеющаяся в почве влага обеспечивает электрохимический механизм коррозии. Скорость. коррозии возрастает в торфянистых и болотистых грунтах.
Подземная коррозия может осложняться биокоррозией. Микроорганизмы и продукты их жизнедеятельности могут разрушать защитные покрытия, изменять характеристики почв.
Большой вред наносит и коррозия под действием блуждаюгцих токов. Особенно опасен постоянный ток. При движении трамваев, электропоездов часть электротока уходит в почву, нападает на трубопроводы и другие подземные металлические конструкции, анодные участки которых являются выходом блуждающих токов в грунт Именно на анодных участках происходит интенсивная коррозия металлоконструкций.
