
- •§ 1. Природные носители
- •§ 2. Синтетические полимерные носители
- •§ 5. Природные носители (липиды)
- •§ 7. Макропористые кремнеземы
- •§ 8. Другие неорганические носители
- •§ 1. Носители для адсорбционной иммобилизации
- •2. Методика адсорбционной |м мобилизации
- •§ 3. Природа адсорбционных взаимодействий фермента с носителем
- •§ 5. Способы увеличения эффективности связывания фермента с носителем
- •§ 6. Преимущества и недостатки адсорбционной иммобилизации
- •§ 7. Иммобилизация ферментов в гелях, полученных полимеризацией мономеров
- •§ 8. Иммобилизация ферментов в гелях, полученных из готовых полимеров
- •§ 9. Влияние различных факторов
- •§10. Преимущества и недостатки иммобилизации ферментов путем включения в гель
- •§ 11. Микрокапсулирование
- •§ 12. Двойное эмульгирование
- •§ 13. Включение в волокна
- •§ 14. Включение в лилосомы
- •§ 15. Преимущества и недостатки иммобилизации с использованием полупроницаемых оболочек
- •§ 16. Двухфазные системы типа
- •§ 17. Микромульемм
- •§ 1. Основные принципы конструирования препаратов ковалентно иммобилизованных ферментов
- •§ 2. Химическая структура ферментов и их функциональные группы
- •§ 3. Приемы химической (ковалентнон) им мобилизации белков
- •§ 4. Недостатки и преимущества получения
- •§ 1. Кинетические параметры ферментативных реакций
- •§ 2. Влияние иммобилизации на состояние фермента
- •§ 3. Эффекты распредепения реагентов в катализе иммобилизованными ферментами
- •2 Cosh of -- I
- •1. Распределение протонов- в качестве примера рассмотрим
- •§ 1. Воздействия и вещества, вызывающие инактивацию ферментов
- •§ 2. Молекулярные механизмы инактивации ферментов
- •Лиэинояланин
- •Op нйтиноаланн н
- •§ 3. Влияние иммобилизации на инактивацию ферментов
- •§ 4. Подавление с помощью иммобилизации первичных обратимых стадий денатурации и диссоциации матнвных белков
- •§ 5. Пучи стабилизации ферментов,
- •§ 1. Реактивация инактивированных ферментов
- •§ 2. Регенерация кофакторов (коферментов}
- •V фермент б /
- •37, 41. 42, 44, 47, 79, 80 Фосфорилирование 124, 127
ннолошн
ИВ.Березин
НЛ.Клячко
АВ.Левашов
К.Мартинек
ВВМожаев
Ю.Л.Хмельницкий
ИММОБИЛИЗОВАННЫЕ ФЕРМЕНТЫ
, *\ т • ^|«1«1, t



. • *_ . •
•*.*•-»
i *•■*••*•
•Л *Л-'Л :"*"««*

. • •. *
■■■■>•■
-■£■■*■
г
<■•••*»*•■
ШОТЕННОЛОШН
ел
UIUDUDHH3iDng
в8-ми книгах
ШОТЕННОЛОШР!
Под редакцией НС Егорова
ВДСамуилова

 И.В.Березйн|
И.В.Березйн|
HJ 1.Клячко
АВЛевашов
КМартинек
ВЯМожаев
ЮЛХмельницкий
Москва
«Высшая
школа»
1987

![]()
ББК 30.6 Б63
УДК 574.6
Рецензенты:
кафедра биотехнологии микробного синтеза Московского технологического института пищевой промышленности (зав- кафедрой проф. Кан-тере В. Мг) и д-р техн. наук Попов В. Г. (ПО *Биопрепарат»)
ю Министерством высшего и среднего специального образования СССР в качество учебного пособия для студентов биологических специальностей высших учебных заведений.
Биотехнология: Учеб. пособие для вузов. В 8 кн./Под Б63 ред. Н. С. Егорова В. Д. Самуилова. Кн. 7: Иммобилизованные ферменты/[И, В. Ьсрезин|, Н. Л. Клнчко, А. В. Левашов и др. — М.: Высш. шк., 1987. 159 — с.: ил.
Рассмотрены неорганические и органические носители (пилложки), химические к физические способы связывания белков (ферментов)- Проанализированы ки нети ко термодинамически особенности катализа иммобилизованными ферментами, их стабильность и другие физнко-кимичес&не свойства.
2010000000(4309000000) 510 ББК 30.6 + 28.07
Б КБ—53—9—86 iinz.
001 (01)-87 ^
© Издательство «Высшая школа», 1987
ПРЕДИСЛОВИЕ

В последние 10—15 лет на стыке ряда химических и биологических дисциплин сформировалось новое научно-инженерное направление — химическая энзимология. Стремительное развитие химической энзимологии обусловлено созданием нового типа гетерогенных биоорганических катализаторов — иммобилизованных ферментов. Целесообразность исследований в этом направлении и важность внедрения иммобилизованных ферментов в практику подчеркнуты постановлением ЦК КПСС и Совета Министров СССР «О дальнейшем развитии физико-химической биологии и биотехнологии и использовании их достижений в медицине, сельском хозяйстве и промышленности» (1981), а также в последующих постановлениях.
Проблема создания промышленных образцов иммобилизованных ферментов объединяет необычайно широкий круг специалистов самого разного профиля. Это, в свою очередь, ставит перед высшей школой задачу подготовки таких специалистов.
К настоящему времени в мировой и советской научной литературе имеются десятки обзоров, сборников и монографий, посвященных получению, свойствам и использованию иммобилизованных ферментов. Однако, как правило, эти издания рассчитаны на узкий круг специалистов, имеющих соответствующее образование в области физической химии ферментов или инженерной энзимологии. Учебных пособий для более широкой аудитории в отечественной литературе нет.
Цель настоящего учебного издания состоит в том, чтобы по возможности в общедоступной форме рассмотреть современное состояние проблемы иммобилизованных ферментов, наметить пути решения ее ключевых вопросов и дать верную ориентацию в этой области,
В составлении настоящего учебного пособия принимали участие И. В. Березин (предисловие, введение, заключение), Н. Л. Клячко (гл. I, VI), А. В. Левашов (гл. III), 1С Мартинек (предисловие, введение, заключение), В. В, Можаев (гл. IV, V, VI), Ю. Л. Хмельницкий (гл. II). Редактирование этой книги проведено И. В. Берез иным и А. В, Левашовым.
Авторы выражают глубокую благодарность рецензентам: Д-ру техн. наук В. Г. Попову и кафедре биотехнологии микробного синтеза Московского ордена Трудового Красного знамени технологического института пищевой промышленности (зав, кафедрой проф. В. М. Кантере) за ценные замечания и советы.
Авторы
ВВЕДЕНИЕ

Ферменты и ферментативные системы традиционно применяются в самых различных областях практической деятельности: в пищевой, фармацевтической, текстильной, кожевенной и других отраслях промышленности, в медицине, сельском хозяйстве, органическом синтезе, химическом анализе и т. д. Тем не менее развитие прикладной энзимологии долгое время сдерживалось дороговизной или полным отсутствием на мировом рынке нужных ферментов, особенно их чистых препаратов. Очевидно, можно ожидать в недалеком будущем благодаря успехам микробиологии коренного решения вопроса производства соответствующих ферментов в достаточном количестве.
Возможности применения ферментов осложнены, кроме того, еще, по крайней мере, двумя причинами. Во-первых, ферменты неустойчивы при хранении, а также при различных воздействиях, особенно тепловых. Во-вторых, многократное использование ферментов затруднено из-за сложности их отделения от реагентов и продуктов реакции. По этим причинам практическое использование ферментов могло быть ограничено, но уже на сегодняшний день найдены пути решения и этих проблем.
Принципиально новые перспективы открылись перед прикладной энзимологией в результате создания иммобилизованных ферментов, Дж, Нельсон и Е. Гриффин еще в 1916 г. показали, что инвертаза, адсорбированная на угле (т. е. иммобилизованная), сохраняет каталитическую активность. В 20—30-х годах работы по изучению адсорбции белков и ферментов были продолжены, однако исследования этого периода представляли главным образом академический интерес и не преследовали практических целей. В 1939 г. Дж. Пфанмюллер и Г. Шлейх получили первый патент на применение адсорбированных на древесных опилках протеолитических ферментов для обработки шкур. Принципиально важный шаг в направлении создания прочных конъюгатов ферментов с носителями был сделан в 1953 г. Н. Грубхофером и Д. Шлейтом. впервые применившими метод ковалентного связывания.
Для исследований 50—60-х годов характерна уже достаточно четкая осознанность практической значимости развиваемого направления. Немалая заслуга в этом принадлежит группам
Г. Манеке и Э. Канальского. В результате связывания фермента на носителе были созданы гетерогенные катализаторы, для которых на первой конференции по инженерной энзимологии в Хенникере (США) в 1971 г., был узаконен термин «иммобилизованные ферменты». В литературе все еще встречаются и другие термины, например «нерастворимые ферменты», «матрицированные ферменты» и т. п., смысл которых достаточно конкретен: ими обозначают препараты ферментон, связанных на нерастворимых носителях. Однако понятие «иммобилизация* можно и нужно понимать шире, а именно, как любое ограничение свободы движения белковых молекул (или их фрагментов!) в пространстве. Помимо связывания с нерастворимым носителем этого можно также достичь, например, путем внутримолекулярной или межмолекулярной «сшивки» белковых молекул низкомолекулйрными бифункциональными реагентами или же присоединением фермента к растворимому полимеру. Такие препараты иногда называют ферментами, модифицированными «сшивающими» или, соответственно, полимерными реагентами.
Иммобилизованные ферментные препараты обладают рядом существенных преимуществ при использовании их в прикладных целях по сравнению с нативными предшественниками. Во-первых» гетерогенный катализатор легко отделить от реакционной среды, что дает возможность: а) остановить в нужный момент реакцию; б) использовать катализатор повторно; в) получать продукт, не загрязненный ферментом. Последнее особенно важно в ряде пищевых и фармацевтических производств.
Во-вторых, использование гетерогенных катализаторов позволяет проводить ферментативный процесс непрерывно* например в проточных колоннах, и регулировать скорость катализируемой реакции, а также выход продукта путем изменения скорости потока.
В-третьих, иммобилизация или модификация фермента способствует целенаправленному изменению свойств катализатора, в том числе его специфичности (особенно в отношении к макро-молекулярным субстратам), зависимости каталитической активности от рН> ионного состава и других параметров среды и, что очень важно, его стабильности по отношению к различного рода денатурирующим воздействиям. Отметим» что крупный вклад в разработку общих принципов стабилизации ферментов был сделан советскими исследователями.
В-четвертых, иммобилизация ферментов дает возможность регулировать их каталитическую активность путем изменения свойств носителя под действием некоторых физических факторов, таких, как свет или звук. На этой основе создаются механо-и зву ко чувствительные датчики, усилители слабых сигналов и бессеребряные фотографические процессы.
В результате внедрения нового класса биоорганических катализаторов— иммобилизованных ферментов» перед прикладной энзимологией открылись новые, ранее недоступные пути разви-
тия. Одно лишь перечисление областей, в которых находят применение иммобилизованные ферменты, могло бы занять немало места. Однако в этом нет необходимости, поскольку прикладным аспектам и достижениям инженерной энзимологии целиком посвящена книга 8 серии «Биотехнология». Здесь важно лишь отметить, что успех практического использования препаратов иммобилизованных ферментов в значительной степени определяется подготовительным этапом работы — выбором подходящего носи* теля и метода иммобилизации, а также знанием кинетико-термо-динамических особенностей катализа иммобилизованными ферментами. Именно рассмотрению этого круга вопросов посвящено данное учебное пособие. Кроме того, уделено внимание проблемам стабильности ферментов вообще и иммобилизованных в частности, а также сформулированы общие принципы стабилизации. Специальная глава отведена способам регенерации компонентов систем с иммобилизованными ферментами.
Глава
![]()
ДЛЯ ИММОБИЛИЗАЦИИ
ФЕРМЕНТОВ
 Для
получения
иммобилизованных
ферментов
используется
огромное
число
носителей,
как
органических,
так
и
неорганических.
Основные
требования,
предъявляемые
к
материалам,
которые
могут
быть
применены
для
иммобилизации
ферментов,
следующие
(Дж.
Порат,
1974): 1 —высокая
химическая
и
биологическая
стойкость;
2 —
высокая
механическая
прочность
(в
первую
очередь»
по
отношению
к
истиранию);
3 —
достаточная
проницаемость
для
фермента
и
субстратов,
большая
удельная
по-верхность,
высокая
вместимость,
пористость;
А
—
возможность
получения
в
виде
удобных
в
технологическом
отношении
форм
(гранул,
мембран»
труб,
листов
и
т.
д.);
5 —
легкое
переведение
в
реакционноспособную
форму
(активация);
б
—
высокая
гидро-фильность,
обеспечивающая
возможность
проведения
реакции
связывания
фермента
с
носителем
в
водной
среде;
7 -■ невысокая
стоимость.
Отсутствие
носителей,
удовлетворяющих
одновременно
всем
этим
требованиям,
и
разнообразие
задач,
стоящих
перед
экспериментаторами,
обусловливают
широкий
набор
применяемых
для
иммобилизации
материалов.
Для
получения
иммобилизованных
ферментов
используется
огромное
число
носителей,
как
органических,
так
и
неорганических.
Основные
требования,
предъявляемые
к
материалам,
которые
могут
быть
применены
для
иммобилизации
ферментов,
следующие
(Дж.
Порат,
1974): 1 —высокая
химическая
и
биологическая
стойкость;
2 —
высокая
механическая
прочность
(в
первую
очередь»
по
отношению
к
истиранию);
3 —
достаточная
проницаемость
для
фермента
и
субстратов,
большая
удельная
по-верхность,
высокая
вместимость,
пористость;
А
—
возможность
получения
в
виде
удобных
в
технологическом
отношении
форм
(гранул,
мембран»
труб,
листов
и
т.
д.);
5 —
легкое
переведение
в
реакционноспособную
форму
(активация);
б
—
высокая
гидро-фильность,
обеспечивающая
возможность
проведения
реакции
связывания
фермента
с
носителем
в
водной
среде;
7 -■ невысокая
стоимость.
Отсутствие
носителей,
удовлетворяющих
одновременно
всем
этим
требованиям,
и
разнообразие
задач,
стоящих
перед
экспериментаторами,
обусловливают
широкий
набор
применяемых
для
иммобилизации
материалов.
ОРГАНИЧЕСКИЕ ПОЛИМЕРНЫЕ НОСИТЕЛИ
Существующие в настоящее время органические полимерные носители можно разделить на два класса: 1 — природные полимеры, 2 — синтетические полимерные носители. В свою очередь класс природных полимеров можно подразделить на группы в соответствии с их биохимической классификацией: полисахарид-ные, белковые и липидные носители. Синтетические полимеры также могут быть подразделены на группы, например, в соответствии с химическим строением основной цепи макромолекул: полиметиле но вые, полиамидные и полиэфирные носители.
К рассматриваемым носителям предъявляется ряд дополнительных требований, обусловленных методом иммобилизации, свойствами иммобилизуемого фермента и способом дальнейшего
использования препарата: I — при ковалеитной иммобилизации носитель должен связываться только с теми функциональными группами на белке, которые не являются ответственными за катализ, и 2 — они не должны оказывать ингнбнрующего действия на фермент. При проведении иммобилизации необходимо также учитывать, что наличие противоположных знаков заряда на носителе и ферменте облегчает связывание фермента, одноименных — затрудняет; уменьшение размера частиц носителя способствует увеличению количества связанного препарата.
Наиболее широко используются для иммобилизации ферментов природные полисахариды и синтетические носители поли-метиленового типа. Остальные типы носителей применяются значительно реже.
Рассмотрим основные классы полимерных носителей.
§ 1. Природные носители
Большое значение природных полимеров в качестве носите лей для иммобилизации объясняется их доступностью и наличием реакционно-способных функциональных групп (в исходном или модифицированном препарате), легко вступающих в различные химические реакции, а также высокой гидрофильностыо. К недостаткам природных носителей можно отнести неустойчивость к воздействию микроорганизмов и относительно высокую стоимость многих из них.
Полисахариды. Наиболее часто для иммобилизации используют целлюлозу, декстран, а га розу и их производные.
Целлюлоза представляет собой поли-],4-Р-£>-глюкопиранозил-£>-глкжопиранозу

Целлюлоза отличается высокой степенью гидрофильности, а наличие большого числа гндроксильных групп дает возможность ее легко модифицировать путем введения различных заместителей. Препараты целлюлозы для придания им химической устойчивости «сшивают» эпихлоргидрнном. Для увеличения механической прочности целлюлозу гранулируют путем частичного гидролиза, в результате которого разрушаются ее аморфные участки. На их место для сохранения пористости между кристаллическими участками вводят химические сшивки. Гранулированная целлюлоза благодаря простоте получения, сравнительно низкой стоимости относится к удобным носителям для иммобилизации ферментов и аффинной хроматографии.
Гранулированную целлюлозу довольно легко превращают в
ю
Таблица L Целлюлоза и некоторые ее производные
 Заместитель
по
ОН-групие
Заместитель
по
ОН-групие
Название препарата
Фирма


NH:![]()
ОРОаН
ОСНаСООН O(CHa)aNH*
Целлюлоза
Аминоэтялцеллюлоза
Фосформл целлюлоза (Р-10)
Целлюлоза
Диэтиламиноэтнлцел-поза
Карбокснметнлцеллю-за
А м нноэтил цел л юл оэа
п -Амин обензон л целлюлоза
«Whatman» (Англня)
То же
«Sigma» (США)
*Bk)-Rad-Labs>
(США)
ОСОСН,Вг
O(CH2>aN(CaH5h
![]()
OCH^CONHNHs ОСОСНгВг
Бром аиетн л целл юлоэа
Бенэонлдиэтнламнно
этнлцеллюлозз
Г ндразидка рбокснметнл -
целлюлоза
Ьромя цетил целл юлояа
* ~ Ам ннобензилоксн метил цел л юлоэа
«Serva» (ФРГ) «Reanal» {ВНР)
То же
«Miles Labs» (Англня)
То же То же
I NHs
O(CH5)2N(C*H6)a
OCHjCOOH
![]()
NH?
осн.
O(CHa)aSO3H O(CHahfi(CaHsb
Д Э АЭ - пел л юл оз а
КМ- целл юлоза
п-А мн н обензнл целлюлоза
С ул ьфоэтнл целл юл оза
Триэтил аммоннйэтнл-
цел.пю;киа
НПО «Биохим-реактнв»
То же
 различные
ионообменные
производные,
В
табл.
I
приведены
основные
промышленные
марки
целлюлозы,
выпускаемые
различными
фирмами.
различные
ионообменные
производные,
В
табл.
I
приведены
основные
промышленные
марки
целлюлозы,
выпускаемые
различными
фирмами.
Недостатком целлюлозы как носителя можно считать ее неустойчивость к воздействию сильных кислот, щелочей н окнсли-телей.
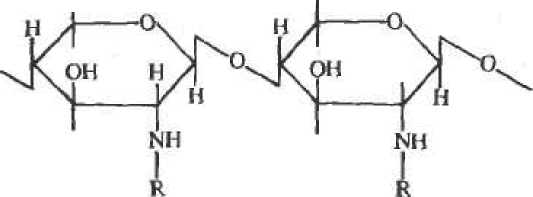
Хитин-—природный аминополнсахарид. Его можно рассматривать как целлюлозу, в которой СН^ОН-группа заменена ацет-амндным остатком:
И
 СН2ОП
СН2ОП
сн, он
JO
(в хитине R=
в хитозане R =—Н)
Хитин — основной компонент наружного скелета ракообразных, насекомых, а также клеточных оболочек некоторых грибов. Это соединение является отходом промышленной переработки креветок и крабов, поэтому доступно в больших количествах при относительно низкой стоимости.
Хитин обладает пористой структурой, не растворяется в воде, разбавленных кислотах и щелочах, а также в органических растворителях. Для переведения в реакционноспособную форму он может быть модифицирован глутароиым альдегидом, а также солями тяжелых металлов [например, Ti(IV)].
Обработка хитина концентрированными растворами щелочей (деацилирование) приводит к образованию хитозана. Хитозан, имеющий свободные аминогруппы, может использоваться для ковалентной иммобилизации ферментов с помощью таких бифункциональных реагентов, как диа льде гиды, диизоцианаты (см, гл. ill). В отличие от хитина хитоэан растворяется в минеральных и органических кислотах, поэтому для иммобилизации он часто применяется в виде растворов (рН 3—7).
Употребление хитоэана в качестве носителя дает хорошие результаты, так как полученные препараты иммобилизованных ферментов обладают высокой каталитической активностью и устойчивостью к микробному воздействию; наблюдается также существенное повышение термостабильности белков» иммобилизованных на хитозат'.
Декстран — поли-1,6-а-/)-глюкопиранозил-0-гл1ОКопирано-за — разветвленный полисахарид из бактериальных источников, содержащий остатки глюкозы, связанные, в основном, 1,6-глюко-знднымн связями (а также, 1,2-, 1,3- и 1,4-связями):
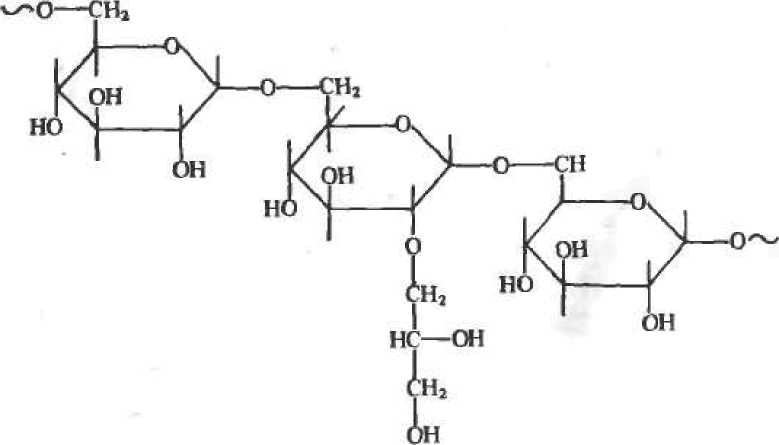
12
Гели на основе декстрана, сшитые эпихлоргидрнном» выпускаются фирмой «Pharmacia» (Швеция) под названием «сефа-декс» и «Reanab (ВНР) под названием кмолселект». При высушивании сефадексы легко сжимаются, а в водных растворах сильно набухают. Эти качества выражены тем сильнее, чем меньше процентное содержание сшивки. Изменением доли сшивки регулируется средний размер пор, образуемых пространственной сеткой геля.
Следует отметить, что продажные препараты сефадексов содержат небольшое количество карбоксильных групп, что придает им некоторое сродство к катионам Этот факт необходимо учитывать при иммобилизации металлозависимых ферментов.
Обращают на себя внимание такие свойства гелей на основе декстрана, как высокая химическая стойкость и гидрофиль-ность (из-за наличия большого количества гидроксильных групп), Сефадексы G-типов различаются по степени сшитости и, следовательно, по степени набухания и по пористости. Существуют разновидности модифицированных сефадексов для использования в органических растворителях (LH-20 н LH-60).
Фирмы «Pharmacia» и «Reanab выпускают также ряд производных декстрана, содержащих различные функциональные группы (табл. 2),
К группе декстранов можно отнести крахмал, являющийся смесью полисахаридов, основным компонентом которой является амилоза — поли-1,4-а-£)-глюкопиранозил-£) -глюкопираноза и амилопектин — разветвленный полисахарид, состоящий из остатков £>-глюкозы, связанной 1т4-а-глюкозидными связями, а в местах разветвлений — 1,6-оглюкозидными связями.
Химической модификацией крахмала сшивающими агентами, такими, как формальдегид, глиоксаль, глутаровый альдегид» получен новый носитель — губчатый крахмал, обладающий повышенной устойчивостью по отношению к ферментам, гидролизую-
Таблица 2. Коммерческие препараты производных декстрана
 Функциональная
группа
Функциональная
группа
Название и марка
Фирма


 ОСНгСООН
ОСНгСООН
OCH2CH*N ( —СН(ОН)СНЭ
OCHsCOOH
Карбо кс и мети л сефа деке (СМ)
Сульфоп ропнлесфадекс <SP)
Д иэтил а м н ноэти л сефа -деке IDEAE)
Днэтщ] (2-окси пропил) амнноэтнлсефадекс (QAE)
Молселект (СМ)
Молседект (SE)
Молсе-лект (DEAE)
«Pharmacia» (Швеции)
«Reanal» (ВНР)
щим полисахариды. Введение днэтаиол- и триэтаноламиннык групп дает возможность применять губчатый крахмал для иммобилизации различных ферментов.
На основе декстранов могут быть получены водорастворимые препараты с различными функциональными группами, применяемые в медицине как носители лекарственных веществ. Выбор носителей иа основе декстрана для медицинских целей обусловлен, в частности» тем, что они легко подвергаются биодегра-дзции.
Агароза ■— поли-{5-галактопиранозил*3,6-ангидро-а-/^галакто*-пираноза:
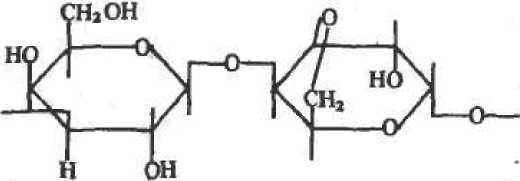
Она широко используется как носитель для иммобилизации. Однако стоимость агарозы довольна высока, поэтому разрабатываются различные методы ее модификации с целью получения легко регенерируемых форм. При охлаждении горячего 2—6%-ного водного раствора агарозы до температуры ниже 45°С образуются прочные крупнопористые гели, представляющие собой сложную смесь из заряженных и нейтральных полисахаридов. В процессе образования геля индивидуальные полисаха-ридные цепи образуют двойные спирали, которые далее агрегируют с образованием «узлов*. При температуре около Ю0°С гель агарозы плавится, поэтому в отличие от сефадексов его нельзя автоклавировать. Высушивание агарозы приводит к необратимой деструкции геля, поэтому его необходимо кранкть в виде водной суспензии.
Гели на основе агарозы производятся фирмами «Pharmacia* (Швеция) и «Bio-Rad Labs» (США) и выпускаются под названиям к «сефароза» и «биогель А» соответственно (табл. 3), а также «LKB» (Швеция) и «IBF* (Франция) — под названием «ультрогель А». При производстве сефарозы агароза подвергается специальной обработке, в частности, из нее удаляются заряженные полисахариды- Различают 3 типа сефароды и 6 типов биогеля А в зависимости от концентрации агарозы (табл. 3).
Дли придания большей химической и термической стабильности препараты сефарозы обрабатывают 2,3-дибромпропанолом в сильно щелочных условиях, В результате такой обработки получается поперечное шитый гель агарозы — сефароза CL (препарат фирмы «Pharmacia»),
Агар выделяют из клеточных мембран некоторых красных морских водорослей. Точный состав ею не известен Однако установлено, что он содержит» по крайней мере, два полисаха-
U
Таблица 3. Агароэа и некоторые ее производные
Функциональная группа |
Название и марка |
Концентра |
Фнрыа |
|
(заместитель по ОН-группе) |
|
ц»я яга розы. |
|
|
_ |
С-ефароэа 6Б |
6 |
«Pharmacia» |
|
|
|
|
(Швеции) |
|
— |
Сефароза 4В |
4 |
То же |
|
I |
Ссфароэа 2В |
2 |
-*- |
|
+ |
ДЭАЭ-сефароза |
6 |
■ д^ |
|
|
CL-6B |
|
|
|
-ОСНаСООН |
КМ—«ефароза CL-6B |
6 |
—*— |
|
—OCN |
Бромциаисефароэа |
4 |
_, |
|
|
4В |
|
|
|
__ОС Н2—С Н—CHs-^O— |
Октнлсефароэа |
4 |
—1— |
|
| |
CL-4B |
|
|
|
ОН |
|
|
|
|
—(CHsJt—СНэ |
|
|
|
|
—ОСНг—СНОН—СНа—О— |
Феннл сефароза |
4 |
—*— |
|
-О |
CL-4B |
|
|
|
|
Биогель А-0,5 |
10 |
«Bio-Rad |
|
■ |
|
|
Labs» (США) |
|
|
Биогель А-1,5 |
8 |
—i— |
|
|
Бногель А-5 |
6 |
—3 |
|
|
Бногель А-15 |
4 |
—»— |
|
|
Биогель А-50 |
2 |
—и— |
|
|
Биогель А-150 |
1 |
—*— |
|
—O(CH2)sN(C2H5)2 |
ДЭАЭ-бногель А |
— |
—>— |
|
|
Активированная |
4 |
<Pharmada> |
|
|
|
|
(Швеция) |
|
—NH—(СНЙ) в—СОО— |
СН—^сефйроза 4В Эпокснактнниро- |
6 |
|
|
|
|
|
||
с/ —О—СН£СН—СНа— |
То же |
|||
й |
наиная сефарояа, 6В |
|
|
|
—О (СНа) 4—О^СНа— |
|
|
|
|
~wm^j FT"""~*Vj -Fli |
|
|
|
|
рнда: а га розу и агаропектин, Г ел к агара образуются аналогично агарозным при охлаждении горячего водного раствора до температуры 38СС. После высушивания гель агара превращается в прозрачную пленку, что позволяет использовать для изучения иммобилизованного в геле фермента оптические методы исследования. К преимуществам агара следует отнести его низкую стоимость и нетоксичность. Отличительной особенностью этого носителя является способность формировать механически прочные гели даже при малых концентрациях в растворе.
Существенного улучшения свойств агара можно достичь сшиванием эпихлоргидрином, диэпоксидными соединениями и т. д. Сшитый агар с регулируемой проницаемостью устойчив к нагреванию даже в щелочной среде, обладает высокой механической прочностью, а наличие большого количества оксигрупп позволяет легко модифицировать носитель. Это дало основания Дж. Порату (1976) считать агар почти идеальным носителем.
Альгиновые кислоты и их соли — это полисахариды бурых морских водорослей, состоящие из связанных р-1,4-связями остатков £>-маннуроноБОЙ кислоты:
 сода
сода
сош
п
Характерным свойством этих носителей является резкая зависимость их растворимости от температуры и рН раствора. Так, альгиновые кислоты хорошо растворимы в горячей воде и плохо — в холодной. Алыинаты кальция обладают способностью образовывать гели, поэтому они используются для иммобилизации ферментов, клеток и органелл путем включения.
Гепарин представляет собой кислый полисахарид, содержащий чередующиеся звенья сульфатированной D-глюкуроноеой кислоты (или L-идуроновой) и сульфатиро ванного глюкоза мина (или N -ацетил -глюкоз амина):
OSOaH
SOjH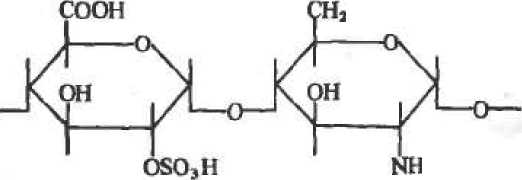
Белки. Использование белков в качестве носителей для нм-
16
мобилизации ферментов представляет интерес как для фундаментальных биохимических исследований, так и для практических целей» в частности для медицины. Этот интерес обусловлен тем, что многие ферменты в клетке функционируют в тесном контакте с другими ее компонентами, & частности с липидами и белками. Поэтому полагают, что изучение поведения ферментов, иммобилизованных на белковых матрицах, позволит понять закономерности функционирования ферментов in vivo. С точки зрения практической значимости важными свойствами этих носителей являются высокая вместимость по отношению к ферментам и способность к биодеградации, а также возможность применения большинства из них (благодаря фибриллярной природе) в виде тонкой толщиной 80 мкм пленки (мембраны). Иммобилизацию на белковых носителях можно проводить как в отсутствие, так и в присутствии сшивающих агентов.
К недостаткам белков как носителей медицинских препаратов для использования in vivo следует отнести высокую иммуно-генность (исключение составляют коллаген и фибрин).
Наиболее часто в качестве носителей применяются структур-ные белки, такие, как кератин, фиброин, коллаген; двигательные белки, в частности миозин, а также транспортные белки» например сывороточный альбумин.
Коллаген — фибриллярный белок группы склеропротеидов, основной компонент хрящей и сухожилии, обладаем высокой прочностью на разрыв. Особенностью этого белка является его высокая гидрофильность. Так, коллаген способен сорбировать от 1 до 5 г воды на 1 г белка, оставаясь в нерастворенном виде и сохраняя волокнистую структуру.
Коллаген — самый распространенный белок высших животных. Легкость выделения коллагена из ряда биологических источников в сочетании со свойственным белкам наличием большого числа групп — участков для связывания ферментов — привлекает внимание к коллагену как к носителю для иммобилизации ферментов. Коллаген используют и в виде модифицированных производных, придавая матрице широкий набор желаемых свойств. Так, блокированием амино- или карбоксильных групп можно изменить поверхностный заряд носителя и, соответственно, гидрофильно — гидрофобный баланс; с помощью сшивающих агентов можно получить сжатую микроструктуру. Наиболее часто коллаген употребляется в азид ной форме. Для этого
карбоксильные группы коллагена®* этерифицируют с последующей обработкой гидразином и азотистой кислотой:
@—CONHNHj
Продуктом переработки коллагена является желатина. Способ ее получения весьма прост-— коллаген длительно обрабаты-
и аллее символом (и) обозначается носитапь
17
вается кипящей водой, в ходе чего гидролизуются некоторые ковалентные связи коллагена, В результате волокнистый, нерастворимый коллаген превращается в растворимую смесь полинеп-тидов, называемую желатиной. Ценность этого носителя, обладающего гелевой структурой, заключается в его нетоксичности, легкости биодеградации, что позволяет применять желатину в фармацевтической и пищевой промышленностих.
Другим весьма распространенным фибриллярным белком группы склеропротеидов является кератин. Из кератина почти полностью состоят шерсть, волосы, роевые покровы, шелк и т. д. Как правило, кератин получают при переработке перьев (побочный продукт .птицеперерабатывающих фабрик). Таким образом, кератин дешев и доступен в больших количествах, что немаловажно при использовании белков в качестве носителей.
Существуют две формы кератина — аир. Важной особенностью а-кератина является высокое содержанке цистеина, что представляет особый интерес для иммобилизации ферментов, содержащих свободные SH-группы. р-Кератины, в частности фиброин (белок шелка и паутины), не содержат остатков цистеина, но в них очень высокое содержание глицина н аланнна, что необходимо для образования вытянутой зигзагообразной конформа-ции полипептидной цепи. Для 0-конформации характерны межцепочечные водородные связи, в образовании которых участвуют все пептидные группы ji-кератина, что придает значительную устойчивость ^-структуре- Молекулярные отличия влияют на механические свойства. Так, нити fj-кератина обладают мягкостью, гибкостью и нерастворимостью, однако уступают по прочности а-кератину. Выбор той или иной формы кератина для иммобилизации определяется конкретной задачей, стоящей перед исследователем .
При иммобилизации ферментов на носителях белковой природы нельзя не считаться с появлением диффузионных ограничений, определяемых гелевой структурой матрицы. Интересное решение проблемы диффузионных ограничений было найдено в случае использования в качестве носителей бел ков-глобул и но в хлопчатника. Так как комплекс фермент-носитель способен находиться как в растворимой, так и в нерастворимой форме в зависимости от ионной силы раствора, то, изменяя последнюю, можно переводить комплекс в растворимую форму и облегчать, например, переработку нерастворимых в воде субстратов. Здесь укажем также, что подобным свойством обладают и некоторые синтетические полимеры, в частности полиэлектролиты и их комплексы, находящие все более широкое применение для иммобилизации (ферментов.
