
Клин рук-во по ЧМТ том 1
.PDFБиомеханика и основные звенья патогенеза черепно мозговой травмы
повреждениями (104). Позже ее причиной может быть неадекватное восстановление кровопотери и назначение мочегонных средств, седативных пре¬ паратов с периферическим сосудорасширяющим действием, а также использование барбитуратов и пропофола с кардиодепрессивным эффектом. Кро¬ ме того, гипотензия может наблюдатся у септичес¬ ких больных, вследствие развития полиорганной недостаточности (5, 56, 108, 110).
Наиболее опасны эпизоды артериальной гипотензии при сдавлениях головного мозга; при этом летальность увеличивается в 2—3 раза (5, 95, 109, 116, 124, 132).
Объемный мозговой кровоток в норме состав¬ ляет 50 мл/100г/мин, обеспечивая потребление мозгом кислорода в среднем 3,2 мл/100г/мин. Та¬ кой уровень мозгового кровотока и кислородного снабжения необходим для обеспечения высокого уровня энергетического обмена и функциональной активности мозга. Регуляция мозгового кровотока осуществляется за счет метаболического, химическо¬ го, нейрогенного и миогенного механизмов. Установ¬ лены критические величины объемного мозгового кровотока: при его снижении до 50% наблюдаются обратимые нарушения функции мозга, при стой¬ ком снижении кровотока ниже 35% от нормы или кратковременном снижении ниже 20% эти нару¬ шения приобретают необратимый характер и раз¬ вивается ишемический инфаркт мозга (83, 110.
Нарушения мозгового кровотока при Ч М Т ха¬ рактеризуются разнонаправленными изменениями и определяются видом и тяжестью травматического поражения головного мозга. П ри этом возникают расстройства ауторегуляции и реактивности цереб¬ ральных сосудов, что приводит к нарушению соот¬ ветствия объемного мозгового кровотока метаболиз¬ му и функциональной активности мозга (41, 100).
П р и ч и н о й уменьш ения объемного мозгового кровотока может быть снижение церебрального перфузионного давления или повышение резис¬ тентности мозговых сосудов, вследствие отека мозга или вазоспазма при субарахноидальном кровоиз¬ лиянии (67), сдавление магистральных артерий при дислокации и ущемлении мозга. Повышение вяз¬ кости крови в результате гемоконцентрации также способствует ухудшению мозгового кровотока на капиллярном уровне (70).
Причиной относительного или абсолютного уве¬ личения объемного МК (синдром избыточной пер¬ фузии) по отношению к метаболизму мозга могут быть: тканевой лактацидоз, изменения внутри- и внеклеточного ионного гомеостаза, вызывающие парез церебральных сосудов, расстройство цент¬ ральных норадренергических механизмов регуля¬ ции МК при повреждении ствола мозга. Повыше¬ ние объемного кровотока бывает также обусловлено изменениями газового состава крови при наруше¬ ниях дыхания различного генеза (104, 109).
4.2.7. Нарушения газового состава крови
Гипоксемия является крайне неблагоприятным прогностическим фактором при Ч М Т (30, 56, 85, 109, 110). Наиболее часто гипоксемия сочетается с гиперкапнией и приводит к возрастанию внутри¬ черепного давления и усилению отека мозга (64, 107).
Причинами гипоксии, а также и гиперкапнии при Ч М Т являются: нарушения дыхания централь¬ ного характера, нарушение свободной проходимос¬ ти дыхательных путей, аспирация крови, рвотных масс, инородных тел, повреждения грудной стен¬ ки и легких, неврогенный отек легких, респира¬ торный дистресс синдром взрослых, синдром жи¬ ровой эмболии, пневмония и др. (44, 110).
Гипоксемия, приводя к снижению количества доставляемого кислорода, тесно связана с механиз¬ мом переноса и отдачи кислорода, а именно с ко¬ личеством эритроцитов, выполняющих транспорт¬ ную функцию крови. Особенно опасно сочетание анемии со снижением мозгового кровотока вслед¬ ствие спазма сосудов мозга или уменьшения це¬ ребрального перфузионного давления (110).
Изменения МК как в сторону его увеличения, так и уменьшения, вплоть до иш емии, нередко обусловлены изменениями газового состава крови и прежде всего СО2 (95, 96). Так, гиперкапния при сохранности химической регуляции М К , приводит к его увеличению (увеличение рС О 2 в артериаль¬ ной крови на 1 mmHg вызывает прирост объемного МК на 2—3%). И наоборот, гипокапния вызывает сужение церебральных сосудов и соответствующее снижение объемного М К . Доказано, что глубокая гипокапния (рСО2 ниже 25 mmHg) является при¬ чиной сужения мозговых сосудов и может привес¬ ти к падению объемного МК и тотальной ишемии мозга (60, 83, 95, 100, 110).
4.2.8. Нейромедиаторные и нейрохимические механизмы
Существенным звеном в реакции мозга на повреж¬ дение является изменение метаболизма нейромедиаторов и их рецепторных аппаратов. Это касает¬ ся большинства нейромедиаторов: ацетилхолина, катехоламинов, моноаминов, возбуждающих нейромедиаторов (глутамата и аспартата). Последние играют особую роль в ближайшей реакции мозга на травму, активируя соответствующие рецепторы и способствуя поступлению и аккумуляции каль¬ ция в клетке. Увеличение внутриклеточного каль¬ ция выполняет триггерную функцию в активации внутриклеточных энзимов (протеаз и липаз), вы¬ свобождение свободных радикалов кислорода, пере¬ киси липидов и деструкции клеток (61, 62).
163
Руководство по черепно мозговой травме
Изменения энергетического обмена вследствие ишемии и гипоксии мозга при Ч М Т характеризуют¬ ся преобладанием анаэробного гликолиза с развити¬ ем лактацидоза мозга, что способствует дальнейшим наруш ениям мозгового кровотока и нарастанию отека мозга (23). П ри этом определение содержа¬ н и я лактата и лактатдегидрогеназы, церебрального изофермента креатинфосфокиназа, нейронспецифической энолазы, основного белка миелина, перекисных соединений в ликворе и оттекающей от мозга крови могут служить биохимическими мар¬ керами степени структурных и метаболических нарушений в мозге (32, 93).
Нейрохимический мониторинг с использовани¬ ем микродиализной техники позволяет проследить динамику нейромедиаторных и метаболических процессов в ткани мозга непосредственно в про¬ цессе интенсивной терапии. П ри этом изменения метаболитов в ткани мозга, полученые с помощью этой техники опережают по времени изменения в Ц С Ж (33, 39, 57).
4.2.9. Черепно мозговая травма и стресс
Тяжелая Ч М Т представляет собой мощное стрессо¬ вое воздействие для организма. И одно из основ¬ ных его проявлений — активизация симпатикоадреналовой системы, причем характер стрессово¬ го ответа имеет как общие для травмы, так и спе¬ цифические для нейротравмы, закономерности . В остром периоде наблюдается значительное по¬ вышение концентрации катехоламинов в крови, ликворе, суточной моче. Этому сопутствуют раз¬ личные вегето-висцеральные реакции в виде арте¬ риальной гипертензии, гипертермии, повышения основного обмена, нарастания белкового катабо¬ лизма и пр. Своеобразие симпатико-адреналовой реакции при Ч М Т зависит от тяжести, локализа¬ ции и уровня преимущественного поражения моз¬ га. У больных с тяжелой травмой и повреждением срединно-стволовых структур мозга наблюдается выраженная активизация как гормонального (ад¬ реналин), так и медиаторного (ДОФА, дофамин, норадреналин) звеньев симпатико-адреналовой сис¬ темы в первые несколько суток после травмы. Гиперергический характер реакции в первые несколько суток сопровождается последующим истощением. Клинически этому сопутствует нестабильность ге¬ модинамики, нарушение сердечного ритма, паде¬ ние сократимости миокарда, расстройство термо¬ регуляции и так далее.
У больных с преимущественным повреждением подкорковых структур реакция активизации симпа- тико-адреналовой системы имеет более длительный характер с последующим отсроченным истощени¬ ем нейромедиаторного звена (ДОФА, дофамина, норадреналин) (24).
4.2.10. Нарушения общего обмена
Втечение первых недель после травмы, особенно тяжелой степени, наблюдаются значительное по¬ вы ш ение общего метаболизма, достигающего в среднем 140% от базового уровня (60). Это связан¬ но со стрессовой реакцией организма на травму, катехолемией, повышением мышечного тонуса, су¬ дорогами, двигательным возбуждением и др. У боль¬ ных с тяжелой Ч М Т возросший катаболизм белка, особенно при недостаточном питании, может сопровождатся потерей азота до 14—25 г в сутки. В этих условиях потеря мышечной массы в течение первых недель после травмы может достигать 30%.
Врезультате возникают общие и местные трофи¬ ческие нарушения (кахексия, пролежни), сниже¬ ние иммунитета, падение содержания белка и кол¬ лоидного давления плазмы крови (7).
4 . 2 . 11 . Нарушения водно электролитного обмена
Черепно-мозговая травма нередко приводит к по¬ вреждению центральных (гипоталамо-гипофизар- ных) и периферических (почечно-надпочечнико- вых) механизмов регуляции водно-электролитного и осмотического гомеостаза. Эти нарушения про¬ являются синдромом избыточной или несбаланси¬ рованной секреции антидиуретического гормона, а также синдромом острого несахарного мочеиз¬ нурения (11, 20).
Синдром избыточной или несбалансированной |
|
секреции антидиуретического гормона заключается |
|
в гипонатриемии, гипоосмолярности и увеличении |
|
объема плазмы. П овыш ение выброса антидиуре¬ |
|
тического гормона может быть связанно с болевы¬ |
|
ми стимулами, хирургическим стрессом и собстве- |
|
но травмой. Частота его при Ч М Т варьирует от 5% |
|
до 12%, |
а у детей может достигать 25%. Высокие |
цифры |
антидиуретического гормона можно обна¬ |
ружить в крови, ликворе и в моче (102, 118). На¬ блюдаемая п ри си н др ом е н е с б а л а н с и р о в а н н о й секреции антидиуретического гормона гипонатриемия и гипоосмолярность могут вызвать развитие отсроченного отека мозга (43).
Несахарное мочеизнурение возникает вследст¬ вие первичного или вторичного повреждения ги¬ поталамуса и гипофиза. В результате возникает абсолютная или относительная недостаточность секреции антидиуретического гормона. Это при¬ водит к чрезмерной потере воды почечными ка¬ нальцами, увеличению содержания натрия, азота мочевины, креатинина и развитию гиперосмолярного синдрома. Стойкое повышение осмолярнос-
ти плазмы |
свыше 310 мосм/л и более |
нарушает |
ф у н к ц и ю |
паренхим атозны х органов, |
ухудшают |
микроциркуляцию, повышает риск гнойно-воспа-
164
Биомеханика и основные звенья патогенеза черепно мозговой травмы
лительных осложнений и сопровождается высокой летальностью (11).
Частота несахарного мочеизнурения при Ч М Т составляет около 2%, однако при переломах в об¬ ласти турецкого седла синдром может наблюдатся значительно чаще (46). Кроме этого несахарное мочеизнурение может наблюдаться при примене¬ нии фенитоина, алкогольной интоксикации, бак¬ териальном менингите, сепсисе, множественной травме, или гипоальбуминемии. Неконтролируемая внутричерепная гипертензия, приводящая к раз¬ витию смерти мозга, как правило, сопровождается несахарным мочеизнурением и грубым гиперосмолярным синдромом (50).
4.2.12. Нарушения терморегуляции
Нарушения терморегуляции, преимущественно в виде гипертермии, часто наблюдаются при Ч М Т. П ричиной является нарушение центральных меха¬ низмов терморегуляции с высвобождением цитокинов в ткани мозга в ответ на травму, интра- и экстракраниальные гнойно-воспалительные ослож¬ нения (89). Опасность гипертермии заключается в увеличении как общих метаболических потребнос¬ тей, так и метаболических потребностей мозга. Повышение метаболизма мозга, при отсутствии аде¬ кватного увеличения объемного мозгового крово¬ тока, может усугублять развитие отека мозга и внут¬ ричерепной гипертензии (39).
4.2.13. Резюме
В течение последних лет благодаря фундаментальным исследованиям, введению в клиническую практику методов визуализации мозга, методов количественной оценки локального и общего церебрального кро¬ вотока и метаболизма, методов мониторного кон¬ троля основных показателей ж изнеобеспечения мозга, полученны новые данные о первичных и вторичных механизмах в патогенезе черепно-моз¬ говой травмы. Дальнейшее совершенствование и внедрение современных принципов и методов ле¬ чения позволило снизить летальность больных с тяжелой Ч М Т, однако при этом возросло количе¬ ство больных, оставшихся глубокими инвалидами (76, 84). Новые перспективы в лечении больных с нейротравмой открываются в связи с возможнос¬ тью воздействия на первичные повреждения мозга с помощью методов генной инженерии. В этом отношении наиболее обнадеживающими являются экспериментальные исследования, свидетельствую¬ щие о возможности стимуляции регенеративных процессов в нервной клетке с помощью доставки в ее цитоплазму фрагмента генома ответственного за синтез нейротрофического фактора (134).
М ожно предполагать, что если в настоящее вре¬ мя лечебные мероприятия в основном преследуют
цель предупреждения или устранения вторичных повреждений, то уже в ближайшем будущем они могут быть направлены на управление процессами восстановления первично поврежденных нервных клеток.
Литература
1. Бабчин Н.С. Общая классификация боевых повреждений черепа и головного мозга и статистические данные // Опыт советской медицины в Великой Отечественной Войне 1941—1945 гг., М., Медгиз. 1952. т. 11.,
с.39 — 51.
2.Блинков С.М., Смирнов Н.А. Смещения и деформации головного мозга. Морфология и клиника. «Медицина», Ленинградское отделение, 1967; 202 с.
3.Бурденко Н .Н . Узловые вопросы нейрохирургии // Вопросы нейрохирургии. 1943. № 3. С. 3—21.
4.Гайдар Б.В., Шулев Ю.А., Парфенов В.Е. Боевые повреждения черепа и головного мозга // Ж. Вопр. ней¬ рохирургии, 1997, № 4, с. 46—49.
5.Гайтур Э.И., Потапов А.А., Амчеславский В.Г., и др.: Значение артериальной гипотонии и гипоксии на догоспитальном периоде для исходов тяжелой сочетанной и изолированной черепно-мозговой травмы. Акту¬
альные проблемы нейрохирургии (тезисы докладов)
г.Сыктывкар, 1996.
6.Громов А.П. Биомеханика травмы. М. Медици¬ на, 1979, 270 с.
7.Данелия Т.З. Оценка и обеспечение энергетичес¬ ких потребностей у нейрохирургических больных, требу¬ ющих интенсивной терапии. Диссертация на соискание ученой степени кандидата медицинских наук, 1986, с.149.
8.Еолчиян С.А. Черепно-мозговая травма, сопровождающаяся повреждением зрительного нерва. Автореф. дисс. канд. мед. наук. Москва, 1996, 38 с.
9.Зотов Ю.В., Щедренок В.В., Бродская Н .И . Вре¬ мя образования травматических внутричерепных гема¬
том // |
Вопр. нейрохирургии. |
1979. № 3 , с. 14—18. |
|
10. |
Исаков Ю.В. Острые |
травматические |
внутриче¬ |
репные гематомы. — М.: Медицина, 1977.— |
262 с. |
||
11.Исхаков О.С. Клинико-патогенетические основы дегидратационной терапии отека мозга в остром перио¬ де ЧМ Т. — Дис. канд. мед. наук. — М., 1985. 172 с.
12.Коновалов А. Н., Самотокин Б. А., Васин Н.Я. и др. К единой междисциплинарной классификации че¬ репно-мозговой травмы. // Суд.-мед. экспертиза, 1988,
№1, 3—7.
13.Лебедев В.В., Кравчук А.Д. Объем хирургических
вмешательств |
при тяжелой Ч М Т // Вопр. Нейрохир. |
1982. № 3. С. |
15—18. |
14.Лебедев В.В., Сарибекян А.С. Вентрикулярный дренаж при острой внутричерепной гипертензии у боль¬ ных с тяжелой черепно-мозговой травмой // Вопр. нейрохир. 1979. № 1. С. 17—19.
15.Лихтерман Л. Б., Потапов А. А. П ринципы клас¬ сификации ЧМ Т. В кн .: Классификация черепно-моз¬ говой травмы. Москва, 1992, с. 21—27.
16.Лихтерман Л.Б., Корниенко В.Н., Потапов А.А. и др. Черепно-мозговая травма: прогноз течения и исхо¬ дов. Москва, 1993, с. 23—33.
17.Лихтерман Л.Б., Хитрин Л.Х. Травматические внут¬ ричерепные гематомы. — М.: Медицина, 1973. 295 с.
165
Руководство по черепно мозговой травме
18.Лошаков В.А. Черепно-мозговая травма при ес¬ тественных и антропогенных катастрофах. Докторская диссертация. М. 1995, 257 с.
19.Мухаметжанов X. Внутричерепная гипертензия в остром периоде тяжелой Ч М Т . Диссертация на соиска¬ ние ученой степени кандидата медицинских наук, Мос¬ ква (1987), с. 250.
20.Потапов A. A. Патогенез и дифференцированное лечение очаговых и диффузных повреждений головного мозга. Докторская диссертация. Москва, 1990, 354 с.
21. Потапов А.А., Гайтур Э.И., Мухаметжанов Х., и др.: Тяжелая черепно-мозговая травма, сопровождающаяся ги¬ поксией и гипотензией у взрослых и детей. В книге: Неот¬ ложная хирургия детского возраста, Москва, Медицина 1996.
22.Потапов А.А., Костанян В.Ж., Зограбян С.Г. и др. Длительное сдавление головы // Ж . Вопр. нейрохир. 1992, № 2, с. 6—10.
23.Промыслов М .Ш . Обмен веществ в мозге и его ре¬ гуляция при черепно-мозговой травме. — М., 1984. 85 с.
24.П ясецкая М .В. Особенности нейромедиаторных реакций и пути их коррекции при интенсивной тера¬ пии тяжелой черепно-мозговой травмы. Диссертация на соискание ученой степени кандидата медицинских наук. Москва, 1986, с. 228.
25. Самотокин Б. А. П ринцип классификации ост¬ рой закрытой черепно-мозговой травмы. // Вопр. ней¬ рохирургии, 1978, 4, 3—10.
26.Свадовский А .И . Динамика посттравматическо¬ го отека и набухания головного мозга. Дис. канд. мед. наук. — М., 1991. 120 с.
27.Шулев Ю.А. Поражения черепа и головного моз¬ га при взрывах. Автореф. дисс. докт. мед. наук, С.-Пе¬ тербург. 1993. 48 с.
28. Adams J.H ., Graham D .I., Gennarelli T.A. Head injury in man and experimental animals-neuropathology. Acta Neurochirurg. 1983: 32 (Suppl):15—30.
29.Adams J.H ., Graham D.I., Gennarelli T.A. Primary brain damage in non-missile head injury. In: Mechanism of secondary brain damage (Eds. A. Baethman et al.) — N.Y.: Plenum, 1986. — p.1—13.
30.Andrews P. J. D. et al. Secondary insults during intrahospital transport of head injured patients // Lancet 335: 327—330, 1990.
31. Andrews R.J., Bringas J.R.,et al .Effects of Nimodipine
and U-74389G on local brain pH and C B F during transient focal brain retraction ischemia and reperfusion. // Poster program of the 64th Annual Meeting of the American Asso¬ ciation of Neurological Surgeons.-Minneapolis. 1996. p. 231.
32. Bakay R.A.E., Sweeney K.M., W ood J.H .: Pathophysiology of cerebrospinal fluid in head injury: I. Patholog¬ ical changes in cerebrospinal fluid solute composition after traumatic head injury // Neurosurgery 18: 234 — 243, 1986.
33. Benveniste H., Huttemeier P.C.: Microdialysis — theory and application // Prog. Neurobiol. 35: 195—215, 1990.
34.Biagas K.V., Uhl M.W ., Schiding J.K. et al.: Assess¬ ment of post traumatic polymorphonuclear leucocyte accu¬ mulation in rat brain using tissue mieloperoxidase assay and vinblastine treatment // J. Neurotrauma, 9, 1992, 363—371.
35.Bostrom K., Helander C.G . Aspects on pathology and neuropathology in head injury. Acta Neurochirurgica, Suppl. 36, 51—55 (1986).
36.Bouma G.J., Muizelaar J.P . Relationship between cardiac output and cerebral blood flow in patients with in¬ tact and with impaired autoregulation // J.Neurosurg. 73: 368—374 (1990).
37. Bruce D.A., Alavi A., Bilaniuk L et al.: Diffuse cere¬ bral swelling following head injuries in children: the syn¬ drome of malignant brain oedema // J. of Neurosurgery, 54, 1981, 170—178.
38. Bullock R., Landolt H., Maxwell W .L., and Fujisawa H.: Massive astrocytic swelling in response to extracellular glutamate — a possible mechanism for post traumatic brain sweling? // Acta Neurochirurgica, 60, 1994, 465—467.
39.Clasen R.A., Pandolfi S., Laing I., Casey D.: Exper¬ imental study of relation of fever to cerebral oedema // J. Neurosurg. 41: 476—581, 1974.
40.Cold G.E., Christensen M.S., Schmidt K: Effect of
two levels of |
induced hypocapnia |
on cerebral autoregulation |
in the acute |
phase of head injury |
coma. Acta Anaesthesiol. |
Scand.25: 397—401, 1981.
41. Cold G .E.: Cerebral blood flow in acute head injury. Acta Neurochir. (Suppl.49): 18—21, 1990.
42. Crooks D.A.: The pathological concept of diffuse axonal injury: Its pathogenesis and the assessment of severity.
J.Pathol. 165: 5, 1991.
43.Darby J.M., Nelson P.B.: Fluid, electrolyte, and acid — base balance in neurosurgical intensive care, in Andrews B.T. (eds): Neurosurgical intensive care, New York: McGrawHill, 1993: 133—162.
44.Demling R.,Riessen R.: Pulmonary dysfunction after cerebral injury // Crit. Care. Med. 18: 768—774, 1990.
45.Diaz-Marchan P.J., Hayman L.A., Carrier D.A., Feldman D.J.: Computed tomography of closed head injury // Neurotrauma / Eds. Narayan R.K., Wilbergen J.E., Povlishock J.T., McGraw-Hill. 1996. P.137—139.
46.Edwards O.M., Clark J.A.: Post-traumatic hypopituitarism // Medicine (Baltimore) 65: 281, 1986.
47.Eisenberg H .M ., Frankowski R.F., Contant C.F., et al. (1988) High-dose barbiturate control of elevated intracranial pressure in patients with severe head injury. J.Neurosurg. 69: 15—23.
48.Faraci F .M . : Endothelium — derived vasoactive fac¬ tors and regulation of the cerebral circulation // Neurosurgery, 33, 1993, 648—658.
49.Feldm an Z., N arayan R.K.: Intracranial pressure monitoring: Techniques and pitfalls, in Cooper P.R. (ed): Head Injury, 3rd ed. Baltimore: Williams and Wilkins, 1993.
50.Fiser D .H ., Jiminez J.F ., W rape V., W oddy R.: Dia¬
betes insipidus in children with brain death // Crit. Care Med. 15: 551, 1987.
51. Fukuda K., Tanno H. Et al.: The blood-brain barrier disruption to circulating proteins in the early period after fluid percussion brain injury in rats // J. of Neurotrauma, 12, 1995, 315.
52.Gennarelli T.A., Thibault L.E., Adams J.H . et al.: Diffuse axonal injury and traumatic coma in the primate. Ann. Neurol. 12: 564. 1982.
53.Gennarelli T.A., Adams J.H ., Graham D .I. Diffuse axonal injury — a new conceptual aproach to an old problem
//Mechanism of secondary brain damage (Eds. A.Baethman et al.) — N.Y.: Plenum, 1986. p.15—28.
54.Gennarelli T.A.: Head injury in man and experimen¬ tal animals: clinical aspects. Acta Neurchir. 32 (Suppl.): 1— 23. (1983).
55.Gentelman S.M., Nash M.J., Sweeting C.J. et al.: Beta amyloid precursor protein (BAPP) as a marker for axonal injury after head injury. Neurosci. Lett. 160: 139, 1993.
56.Gentleman D ., Jennett B. Audit of transfer of uncon¬ scious head injured patients to a neurosurgical unit. Lancet
335:330—334,1990.
166
Биомеханика и основные звенья патогенеза черепно мозговой травмы
57.G oodm an J.C ., Valadka A.B., Gopinath R.G ., Rob¬ ertson C.S. Arginine and citrulline levels in head injured patients measured using microdialysis. // The J. Douglas Miller memorial meeting, Scotland, United Kingdom, 1996, abstract 05—5.
58.Grady M .S., McLaughlin M.R., Cristman C.W . et al.: The use of antibodies targeted against the neurofilament
subunits for the detection of diffuse axonal injury in humans.
J.Neuropathol. Exp. Neurol. 52: 143, 1993.
59.Graham D.I.et al. Ischaemic brain damage in fatal nonmissile head injuries // J. Neurol. Sci. 39: 213—234, 1978.
60.Guidelines for the Management of severe head inju¬ ry. Brain Trauma Foundation, 1995.
61. Hall E. Further studies on the efficacy of the cytoprotective lipid peroxidation inhibitor tirilazad // Interna¬ tional conference on recent advances in neurotraumatology. Italy, 1996, p. 22.
62. Hall E.D ., Andrus P.K., Yonkers P.A. (1993) Brain hydroxyl radical generation in acute experimental head inju¬ ry. J.Neurochem . 60: 588—594.
63. Hall E.D.,Traystman R.J., Secondary tissue damage after CN S injury. The Upjohn Compani, Kalamazoo, Mich¬ igan, 1993.
64. Ishige N.,Pitts L.H.,Hashimoto T.,Nishimura M.C.,Bartkowski H .M .: Effect of hipoxia on traumatic brain injury in rats: Part I and II // Neurosurgery 20: 848—858,1987.
65. Islam N ., Aftabuddin M., Morwaki A., Horri Y.: Detection of D N A damage induced by apoptosis in the rat brain following incomplete ischemia // Neurosience Letters, 188, 1995, 159—162.
66.Ito J., Marmarou A., Barzo P. Et al.: Characterization of edema by diffusion weighted imaging in experimental trau¬ matic brain injury // J. of Neurosurgery, 84, 1996, 97—103.
67.Kakarieka A. Traumatic subarachnoid haemorrhage. Springer-Verlag. Berlin Heidelberg, New York, pp.109 (1997).
68.Kaufman A.M ., Cardozo E. (1992) Aggravation of
vasogenic cerebral |
ed em a by m u ltip le dose |
m a n n ito l . |
J.Neurosurg. 77: 584—589. |
|
|
69. Kellie G. An |
account of the apperance |
observed in |
the dissection of two of three individuals presumed to have perished in the storm of the third and whose bodies were discovered in the vicinity of Leith on the morning of the 4th, November 1821, with some reflections on the pathology of the brain. Transaction of medico-chirurgical society of Edinburg, 1, 84—169, (1824).
70. Kelly D .F ., Doberstein C., Becker D .P.: General prin¬ ciples of head injury management // Neurotrauma / Eds. Narayan R.K., Wilbergen J.E., Povlishock J.T., McGraw-
Hill. 1996. P.71—101. |
|
71. Lewelt W .,et al. // Autoregulation of cerebral |
blood |
flow after experimental fluid percussion injury of the |
brain, |
J.Neurosurg. 53: 500—511, 1980.
72.Marmarou A., Anderson R.L., W ard J.D ., et al.: Im¬
pact of IC P instability and hypotension on outcome in pa¬ tients with severe head trauma. J. Neurosurg.75: S59—S66, 1991.
73.Marmarou A., Shulman K., La Morgese J. Compartmental analysis of compliance and outflow resistance in the cerebrospinal fluid system. J.Neurosurg., 43, p.523—534, 1975.
74.Marmarou A.: Traumatic brain oedema — an over¬ view // Acta Neurochirurgica, S60, 1994, 421—424.
75. Marshall L.F., Servadei F. The outcome of the inter¬ national trial of tirilazad mesylate in moderate and severe head injury. // International conference on recent ad-vances in neurotraumatology. Italy, 1996, p. 25.
76.Marshall L.F., Gautille T., Klauber M.R., et al. The outcome of severe closed head injury. J.Neurosurg. 1991; 75: S28—S36.
77.Marshall L.F., Marshall S.B., Klauber M .R. et al.: A new classification of head injury based on computerized to¬ mography. J. of neurosurgery, V. 75: 1991: S14—S20.
78.Marshall L.F., Marshall S.B.: Medical management of intracranial pressures, in Cooper P.R. (ed): Head Injury, 2rd ed. Baltimore: Williams and Wilkins, 1987.
79.Marshall L.F., Smith R.W., Shapiro H .M . (1979) The outcome with aggressive treatment in severe head injuries. J.Neurosurg. 50: 26 — 30.
80.Mendelow A .D ., Teasdale G .M . Pathophysiology of
head injured // Br.J.Surg.—1983. V.70. № 1 1 . p.641—650. 81. Mendelow A.D ., Crawford P.J.: Primary and second¬
ary brain injury // Head injury (ed. Reilly P. And Bullock R.), Chapman & Hall medical, 1997, pp.71—86.
82.Miller J.D et al. Computed tomography brain edema and ICP in severe head injury. In: Cervos-Navarro J., Ferzt R (eds). Brain edema.. Raven Press. New York, 1980, pp. 413—418.
83.Miller J .D . Head injury and brain ischemia: implica¬ tions for therapy // Br. J. Anaesth, 57: 120—129, 1985.
84.Miller J .D . // Head injury, J.Neurol. Neurosurg. Psychyatry, 56: 440—447, 1993.
85.Miller J .D . et al. Secondary insults to the injured brain
//J. R. Coll. Surg. Edinburgh 27: 292—298, 1982.
86.Miller J . D . Relevance of primary and secondary brain
damage (Eds. A.Baethman et al.) — N.Y.: Plenum, 1986. p.323—328.
87.Miller J .D . Volume and pressure in the craniospinal axis. Clinical Neurosurgery, 22, p. 76—105, 1975.
88.Miller J.D ., Jones P.A., Dearden N .M ., Tocher J.L.: Progress in the management of head injury // Br. J. Surg.
79:60—64, 1992.
89.Miller J.D ., Piper I.R., Jones P.A.: Pathophysology of head injury // Neurotrauma (Eds. Narayan R.K., Wilbergen J.E., Povlishock J.T.), McGraw-Hill. 1996. P.61—69.
90.Miller J .D ., Stanek A.E., Langfitt T.W.: Concepts of cerebral perfusion pressure and vascular compression during intracranial hypertension, in Meyer J.S., Schade J. (eds): Progress in brain research, vol.35: Cerebral blood flow. Am¬ sterdam: Elsevier, 1972: 411—432.
91. Miller J.D .: Traumatic brain swelling and edema // Head injury (ed. P.R. Cooper), Williams & Wikins, Balti¬ more, M D , 1993, pp. 351—354.
92. M onro A. Observations on the structure and function of the nervous system // Creech & Johnston, Edinburg (1783).
93. Moss D.W ., Hendrson A.R.: Enzymes, in Burtis C.A. Ashwood E.R. (eds): Tietz textbook for clinical chemistry. Philadelphia: Saunders, 1944: 735—896.
94.Moss E., Price D.J. (1990) Effect of propofol on brain retraction pressure and cerebral perfusion pressure // Br. J. Anaesth. 65: 823—825.
95.Muizelaar J.P., Marmarou A., W ard J . D . et al.: Ad¬ verse effects of prolonged hyperventilation in patient with severe head injury: A randomized clinical trial // J.Neurosurg.
75:731—739, 1991.
96.Muizelaar J.P., W ard J.D ., Marmarou A., et al. (1989) Cerebral blood flow and metabolism in severely head injured children. Part 2: autoregulation // J. Neurosurg.71: 72—76.
97.Narayan R.K., Greenberg R.P., Miller J . D . et al.: Improved confidence of outcome prediction in severe head injury: a comparative analysis of the clinical examination, multimodality evoked potential, CT scanning and intracranial pressure // J. Neurosurg.54: 751—762, 1981.
167
Руководство по черепно мозговой травме
98.Narayan R.K., Kishore P.R., Becker D .P. et al.: Intracranial pressure: to monitor or not to monitor? A review of our experience with severe head injury // J.Neurosurg.56: 650—659, 1982.
99.Nordstrom C.H., Bjartmartz H., Grande P.O., etal. Intracerebral microdialysis with bed-side biochemical analy¬ sis during neurosurgical intensive care. // International con¬ ference on recent advances in neurotraumatology. Italy, 1996, p. 163.
100.Obrist W .D ., Langfitt T.W., Jaggi J.L., et al. (1984) Cerebral blood flow and metabolism in comatose patients with acute head injury: relationship to intracranial hyper¬ tension // J.Neurosurg.61: 241—253.
101.Osborn A.G .: Diagnosis of descending transtentorial herniation by cranial computer tomography // Radiology 123: 93—96, 1977.
102.Padilla G., Leake J.A., Castro R. Et al.: Vasopressin level and pediatric head trauma // Pediatrics 83: 700, 1989.
103.Peters G., Rothemund E.: Neuropathology of the traumatic apallic syndrome, in Ore G .D ., Gerstenbrand F., Lucking C.H. et al. (eds): The Apallic Syndrome. Berlin: Springer-Verlag, 1977:78—87.
104.Pigula F.A. et al. The effect of hypotension and hypoxia on children with severe head injuries. J.of Pediatric surgery 28: 310—316, 1993.
105.Piper I.: Intracranial pressure and elastance // Head injury (ed. Reilly P. And Bullock R.), Chapm an & Hall medical, 1997, pp.101—117.
106.Pollay M., Fullenwider C., Roberts P.A., Stevens F.A. (1983) Effect of mannitol and furosemide on bloodbrain osmotic gradient and intracranial pressure. J.Neurosurg.
59:945—950.
107.Popp A.J., Feustel P.J., Fortune J.B. // IC U man¬ agement of pulmonary dysfunction in neurosurgical patients
//Clin. Neurosurg. 35: 71—92, 1989.
108.Povlishock J.T.: Traumaticallly induced axonal in¬ jury: Pathogenesis and pathobiological implications. Brain Pathol 2: 1, 1992.
109.Price D.J., Murray A., The influence of hypoxia and hypotension on recovery from head injury. Injury 3: 218— 224, 1972.
110.Price D.J., The intensive care of head-injured pa¬ tient. In: Tinker J. and Zapol W .M .. Care of the critically ill patient. Springer-Verlag, 1992, pp.831—872.
111.Robertson C.S., Contant C.F., Narayan R.K. et al. (1992) Cerebral blood flow, AVDO2, and neurologic out¬ come in head-injured patients // J.Neurotrauma 9: S349S358.
112.Rose J., Valtonen S., Jennett b.: Avoidable factors contributing to death after head injuy // Br.Med.J.2: 615— 618, 1977.
113.Rosner M.J., Daughton S.: Cerebral perfusion pres¬ sure management in head injury // J.Trauma 30: 933—941, 1990.
114.Rothfus W .E., Goldberg A.L., Tabaas J .H . et al.: Calloso marginal infarction secondary to transfalcial herniation // AJN R 8:1073—1076,1987.
115.Schneider G .H ., Kiening K.L., Bardt T., et al. (1995) Decompressive surgery for uncontrollable intracranial hyper¬ tension. 3rd International Neurotrauma Symposium pp.463.
116.Seelig J.M ., Becker D .P., Miller J .D . et al: Trau¬ matic acute subdural hematoma: major mortality reduction in patients treated within four hours // N. Eng. J. Med. 1981: 304: 1511—1518.
117.Sherriff F.E., Bridges LR Sivaloganathan S.: Early detection of axonal injury afler human head irauma using immu-nocitochemislry for beta amyloid precursor protein // Acta Neuropathol 88: 433, 1994 (Berl).
118.Shimoda M., Yamada S., Y amamoto I. Et al.: Atrial natriuretic polypeptide in patients with subarachnoid hem¬ orrhage due to aneurysm rupture: Correlations to hyponatriemia // Acta Neurochir (Wien) 97: 53, 1989.
119.Siesjo B.K. (1992) Pathophysiology and treatment of focal cerebral ischemia: part 1: pathophysiology // J.Neurosurg. 77: 169—184.
120.Smith H.P., Kelly D.L., McW horter J.M . et al. (1986) Comparison of mannitol regimens in patients with severe head injury undergoing intracranial monitoring // J. Neurosurg. 65: 820—824.
121.Soares H .D ., Hicks R.R., Smith D .H ., McIntosh T.K.: Inflammatory leukocyte recruitment and diffuse neuronal degeneration are separate pathological processes re¬ sulting from traumatic brain injury // J. Neuroscience, 15, 1995, 8223—8233.
122.Stalhammar D. Experimental models of head injury
//Acta Neurochirurgica, Suppl. 36,33—46, (1986).
123.Stein S.C. Classification of the head injury // Neu-
rotrauma (Eds. Narayan R.K., Wilbergen J.E., Povlishock J.T.), McGraw-Hill. 1996. P.31—43.
124.Stening W.A. et al. // Experience with acute subdural haematomas. In: New South. Wales. Aust. N. Z. J. Surg. 56: 549—556, 1986.
125.Strich S.J.: Diffuse degeneration of the cerebral white matter in severe dementia following head injury // J. Neurol. Neursurg. Psychiat. 19:163—185 (1956).
126. Takanaschi Y., Shinonaga M., Koh E., Naiton M., Y amamoto I. Prediction for the enlargement of intracranial hemorrhage in head-injured patients with gadolinium en¬ hanced magnetic resonanse image. // International confer¬ ence on recent advances in neurotraumatology. Italy, 1996, p. 183.
127.Tornheim P.A., McLaurin R.L., Sawaya R. (1979) Effect of furosemide on experimental traumatic cerebral ede¬ ma // Neurosurgery 4: 48—51.
128.Valadka A.B., Narayan R.K. Surgical aspects of the head injured // Neurotrauma / Eds. Narayan R.K., Wilbergen J.E., Povlishock J.T., McGraw-Hill. 1996. P.203—225.
129.VanDongen K.J., Braakman R., Gelpke G.J.: The prognostic value of computerized tomography in comatose head-injured patients // J. Neurosurg. 1983: 59: 951—957.
130.W eed L.H. Some limitation of the Monro-Kellie hypothesis // Archives of surgery, 18,1049—1068, 1929.
131.Weissman C.: The metabolic response to stress: an overview and update // Anaesthesiology, 73,1990, 308—327.
132.Wilberger J.E., Harris M., Diamond D.L.: Acute subdural hematoma: Morbidity and mortality related to timing of operative intervention // J. Trauma. 1990: 30: 733 — 736.
133.Yaghamai A., Povilshock J.T.: Traumatically induced reactive change as visualized through the use of monoclonal antibodies targeted of neurofilament subunits // J. N eu - ropathol. Exp. Neurol. 51: 158, 1992.
134.Yang K., Clifton G., Hayes // Gene therapy for central nervous system injury: the use of cationic liposomes: an invited review // J. of Neurotrauma, v.14, N 5, 1997.
135.Yoshida A., Shima T., Okada Y., et al.: Outcome of patient with severe head injury — Evaluation by cerebral perfusion pressure, in Nakamura N ., Hashimoto T., Yasue M. (eds): Hong Kong: Springer-Verlag, 1993, pp.309—312.
Патологическая анатомия черепно мозговой травмы
5
ПАТОЛОГИЧЕСКАЯ АНАТОМИЯ ЧЕРЕПНО МОЗГОВОЙ ТРАВМЫ
Опубликованная в 1949 году монография Л.И. Смирнова «Патологическая анатомия и патогенез травматической болезни головного мозга», в течение нескольких последующих десятилетий была настольной книгой для многих отечественный исследователей (5, 7, 10, 17, 23).
Воснову учения о травматической болезни го¬ ловного мозга легло представление Л.И . Смирнова о том, что патологические процессы, вызываемые че- репно-мозговой травмой, создают сложный комплекс тканевых и патофизиологических изменений, кото¬ рые распространяются на всю центральную нервную систему, независимо от вида повреждающего агента. Уже в момент нанесения травмы, в большинстве слу¬ чаев, возникают изменения в целом, во всем мозге
(25). При этом повреждение мозга происходит не одновременно. После первичного травматического повреждения развиваются отсроченные последствия первичной травмы; вторичного повреждения мозга; и, наконец, процессы репарации. Многочисленные работы по изучению морфологии эксперименталь¬ ной травмы мозга и клинико-анатомический анализ летальных исходов ЧМ Т, проведенных за последние десятилетия отечественными и зарубежными иссле¬ дователями, подтвердили основные положения уче¬ ния Л.И . Смирнова о сущности и течении травма¬ тической болезни головного мозга (128).
Внастоящее время общепринято, что патоло¬ гическая анатомия очаговых повреждений мозга в различные периоды после травмы складывается из следующих основных компонентов:
а) очагов первичного и вторичного некрозов; б) расстройств гемодинамики; в) нарушений ликвородинамики; г) воспалительных процессов асеп¬ тического или септического характера; д) наличия инородных тел с соответствующей тканевой реак¬ цией; е) процессов организации и рубцевания.
К первичным травматическим повреждениям мозга относятся: перелом костей черепа, ушибы и
размозжения мозга, первичные внутричерепные и внутримозговые кровоизлияния, диффузное аксональное повреждение, разрывы ствола мозга.
В группе факторов, способствующих развитию вторичных посттравматических повреждений моз¬ га отнесены: а) увеличение объема мозга, или, как принято обозначать в настоящее время в англоя¬ зычной литературе, набухание мозга, вызванное отеком мозговой ткани, либо артериальной или венозной гиперемией; б) отсроченные интракраниальные гематомы; в) повышение внутричерепно¬ го давления; г) нарушения ликворо-гемодинамики в результате субарахноидального и внутрижелудочкового кровоизлияния (8, 12, 29).
К ак известно, в образовании повреждения уча¬ ствуют и повреждающий фактор и повреждаемая часть тела, и в определенных ситуациях, условия окружающей среды, а также свойства повреждае¬ мой части тела (17, 21). П ри этом, характер череп¬ но-мозговой травмы, в первую очередь, зависит от энергии и физико-механических свойств травми¬ рующего предмета. Множество различных факторов, таких как алкогольная интоксикация, переохлаж¬ дение, состояние общей сопротивляемости орга¬ низма, функциональное состояние кровеносной и ликворной систем могут определять морфологию травмы мозга (15, 158).
У лиц пожилого и старческого возраста (15), страдающих церебральной сосудистой патологией, в посттравматическом периоде часты внутричереп¬ ные гематомы, вторичные сосудистые реакции в мозге, связанные с распространением кровоизлия¬ ний вокруг первичного травматического поврежде¬ ния мозга. Чем старше пострадавший, со значитель¬ ными преморбидными сосудистыми изменениями, тем чаще травма является провоцирующим факто¬ ром ишемических изменений в мозге, вплоть до ишемического инфаркта (76). Чем моложе постра¬ давший, тем реже у пациентов развиваются вто-
169
Руководство по черепно мозговой травме
ричные сосудистые реакции, а также внутричереп¬ ные гематомы. Вторичные повреждения мозга мо¬ гут быть вызваны множеством факторов, таких как повышенное внутричерепное давление, экстракра¬ ниальные заболевания, периферическая артериаль¬ ная гипотония, кратковременная остановка сердца, инф екции (97). Наступающие после травмы мозга процессы настолько сложны и взаимосвязаны, что трудно выделить какие-то из них, как специфи¬ ческие для развития вторичных повреждений.
Значительное влияние на соотношение дистро¬ фических, деструктивных и восстановительных процессов в центральной нервной системе оказы¬ вает так называемое «фоновое» состояние мозга — атеросклероз, гипертоническая эн ц еф ало п ати я, алкогольная энцефалопатия (16), так же как и гене¬ тически запрограммированная естественная смерть клеток или так называемый апоптоз клеток (134).
Известно, что сочетающиеся между собой декомпенсированный метаболический ацидоз, гипотензия и артериальная гипоксемия способствуют формированию прогрессирующих распространен¬ ных некрозов в головном мозге. Так, гипоксическая гипоксия приводит к выраженному отеку моз¬ га, а также к образованию очагов неполного некроза в коре. Гиперосмолярные состояния сопровожда¬ ются формированием очаговых кровоизлияний во¬ круг некротизированных сосудов,развитием очагов полного некроза и субарахноидальными кровоиз¬ лияниями (16). К тяжелым повреждениям нейронов, глии и отеку мозга, может привести прогрессирую¬ щ ая левожелудочковая недостаточность. Избира¬ тельность повреж дения грушевидных н ей р он ов мозжечка (клеток Пуркинье) при гипоксии мозга, хорошо известна еще с прошлого века. Наиболее тяжелые и распространенные изменения нейронов при острой кровопотери наблюдаются в височной и затылочной долях, в гиппокампе, во втором и третьем слоях коры.
Механизм избирательной чувствительности от¬ дельных групп нейронов к гипоксии после Ч М Т, также как и особая их уязвимость с последующим наступлением смерти клетки, все еще остается не уточненным. В качестве причин, обуславливающих или способствующих избирательности поврежде¬ н и я отдельных групп нейронов, рассматривают та¬ кие состояния, как ишемия, инсульт, воспаление, повреждения аксонов, а также воздействие экзо¬ токсинов и даже разница в экспрессии генов (71).
Очевидно, что кажущееся несоответствие тяжес¬ ти локального повреждения мозга, полученного в момент травмы, с клиникой в отдаленном периоде травматической болезни головного мозга, может быть связано, в ряде случаев, с недостаточной оцен¬ кой последующих метаболических, циркуляторногипоксических и сосудисто -гемокоагуляционных нарушений в ткани мозга. И н ы м и словами, вто¬ ричные повреждения мозга, развивающиеся после
травмы, могут быть причиной более тяжелых и необратимых изменений клеток, ткани мозга.
Изучение различных экспериментальных моде¬ лей Ч М Т показало, (86) что травма Ц Н С индуци¬ рует каскад реактивных процессов, которые про¬ грессируют в течение нескольких дней или даже недель, приводя, в конечном счете к необратимым изменениям в ткани мозга (116, 147). Эти отсрочен¬ ные аутодеструктивные процессы, обозначаемые как вторичное повреждение мозга, проявляются в виде нарушения кровотока, изменения метаболизма, а также в иммуно-воспалительных реакциях (1, 97).
Наблюдаемые при этом биохимические изме¬ нения включают в себя гидролиз липид клеточных мембран, активацию свободных радикалов, выра¬ ботку метаболитов арахидоновой кислоты, измене¬ ние в содержании и распределении моно- и дивалентных катионов, изменение нейротрансмиттеров и нейромодуляторов, ионов кальция (127).
Получены данные, показывающие, что на сте¬ пень развития вторичных повреждений мозга ока¬ зывает влияние уровень содержания эстрогенов в крови (143), а также изменения в экспрессии раз¬ личного класса генов, вызванной механическим или каким-либо другим повреждением клеточной мем¬ браны (34, 71, 120). Так, в периконтузионной зоне усиливается экспрессия c-fos, c-jun, hsp70 mRNA, a также экспрессия основного фактора роста фиб - робластов m R N A (77, 107).
Внастоящее время получено достаточно много данных о характере деструктивных и репаративных процессов, свойственных отдельным элементам нервной ткани (10). И как полагают, неврологи¬ ческие нарушения всегда определяются не только
идаже не столько характером повреждения отдель¬ ных нейронов, сколько соотношением числа из¬ мененных и неизмененных нейронов и именно эти соотношением определяется выраженность, стер¬ тость или даже отсутствие клинической картины травматической болезни головного мозга (22). Не¬ сомненно, что клиника отдаленного периода Ч М Т зависит и от выраженности деструктивных процес¬ сов, продолжающихся в отдельных случаях до 9— 15 лет после травмы, и от компенсаторных воз¬ можностей мозга, в частности от внутриклеточной регенерации нейронов, приводящей к гипертрофии нейронов, созданию новых связей (10).
Дальнейшее изучение различных аспектов па¬ тогенеза вторичных повреждений мозга, активно проводимое во многих крупных научных центрах различных стран, не только способствует углубле¬ нию и расширению нашего представления об этой патологии, но и открывает перспективу предотвра¬ щ ения или по крайней мере, уменьшения риска развития тяжелых последствий черепно-мозговой травмы (157).
Внастоящей главе изложены обобщенные пред¬ ставления о патоморфологии черепно-мозговой
170
Патологическая анатомия черепно мозговой травмы
травмы, основанные как на данных литературы (клас¬ сической и современной), так и на опыте изучения Ч М Т в институте нейрохирургии им.Н.Н. Бурденко РАМН .
Классификация черепно мозговой травмы. Об¬ щепринято выделение открытой и закрытой Ч М Т (5, 8,14, 17, 69, 112). К закрытой Ч М Т относят та¬ кие повреждения черепа и мозга, при которых це¬ лостность мягких покровов черепа не нарушена, либо имеется рана мягких тканей головы без по¬ вреждения апоневроза. Случаи перелома костей свода черепа, не сопровождающиеся повреждени¬ ем мягких тканей головы и апоневроза, также рас¬ цениваются как закрытая Ч М Т .
Повреждение мягких тканей головы и апонев¬ роза, либо перелом костей свода с ранением при¬ лежащих тканей, также как перелом основания черепа, сопровождающ ийся кровотечением или ликвореей (из носа или уха) расценивается как открытая Ч М Т. Открытые Ч М Т, в свою очередь, делятся на непроникающие и проникающие. Кри¬ терием для такого суждения является состояние твердой мозговой оболочки. П ри целостности твер¬ дой мозговой оболочки открытую Ч М Т относят к непроникающей; в случаях повреждения твердой мозговой оболочки открытая Ч М Т расценивается как проникающая (8).
Наиболее распространенным принципом клас¬ сификации травмы мозга является деление их на первичные травматические диффузные и очаговые травматические повреждения мозга и вторичные повреждения мозга (7, 8, 14, 57, 69, 112).
5 . 1 . ДИФФУЗНЫЕ ПОРАЖЕНИЯ МОЗГА
Патогенез диффузных повреждений мозга разли¬ чен. Первичное травматическое повреждение моз¬ га, в зависимости от механизма травмы может про¬ являться диффузным аксональным повреждением мозга, либо в виде сочетания диффузного аксонального повреждения с очаговыми ушибами мозга. К диффузным поражениям мозга относят и так на¬ зываемое сотрясение мозга.
Вторичные посттравматические диффузные по¬ вреждения мозга возникают в результате: 1)диффузного отека мозга; 2) диффузной гипоксии моз¬ га; 3) диффузного нарушения кровообращения.
5 . 1 . 1 . Сотрясение мозга
Классическое определение сотрясения мозга, как известно, предполагает отсутствие макроскопичес¬ ких повреждений мозга.
П оиски морфологического субстрата, повреж¬ дение которого дает клинику сотрясения мозга, характеризующуюся с кратковременной утратой
сознания и отсутствием неврологических призна¬ ков очагового повреждения мозга, ведутся в тече¬ ние нескольких последних десятилетий. Первые научные публикации с описанием патоморфологии экспериментального сотрясения мозга (см. 5) и аутопсийного материала клинических наблюде¬ ний (25), относятся к середине 40-х годов. И, тем не менее, даже в середине 60-х годов, многие, как полагал Зильберштейн Х.Н. (5), согласятся с мнением известного нейропатоморфолога S. Scheidegger, высказанным им в 1948 году, что «легче ска¬ зать, что не является сотрясением мозга, чем дать определение этому понятию».
И в 90-х годах остается очевидным, что, без прижизненной визуализации состояния мозга (КТ, М РТ), клинический диагноз сотрясения мозга вряд во всех случаях может быть корректным. Извест¬ но, что у пациента с клиникой сотрясения мозга могут быть различного типа повреждения ткани мозга: от изменений, выявляемых только на элек¬ тронно-микроскопическом уровне до макроскопи¬ чески видимых очаговых повреждений. Так, T. Gennarelli (57) у 28% пациентов с клиникой сотря¬ сения мозга, обнаружил макроскопические повреж¬ дения в виде корковых контузий.
Наиболее полное исследование ультраструкту¬ ры мозга в случаях экспериментального сотрясе¬ ния мозга (ЭСМ ), проведено О. В. Копьевым в 1988 году (9).
По данным О. В. Копьева, центральное и веду¬ щее место в ранних ультраструктурных реакциях (через 5 минут и 2 часа после экспериментального сотрясения мозга), занимают изменения синаптического аппарата коры полушарий мозга и диэн - цефальной области. И зменений ультраструктуры клеток ствола мозга в этот период времени после травмы не определяется. Вторым компонентом из¬ менений является перераспределение внутри- и межклеточной жидкости.
Через 5 минут после Э С М можно обнаружить: а) активацию синаптического аппарата (рис. 5—1); б) набухание только отростков астроцитов; в) рас¬ ширение межклеточных пространств; раннюю гиперхромия нейронов; г) перераспределение ткане¬ вой жидкости; д) уплотнение митохондрий.
Через 2 часа после ЭСМ , отмечается: а) истоще¬ ние функции синаптического аппарата (рис. 5—2); б) набухание тел глиальных клеток; в) гиперхромия истощения нейронов; г) микровакуолизация дендритов; д) набухание митохондрий.
Д .С . Саркисов с соавт. (22), расценивающий со¬ трясение мозга как, один из типов острого диф¬ фузного поражения мозга, также обнаружил пер¬ вичное нарушение синаптических контактов или так называемую диссинапсию.
П ериод относительного однообразия ультра¬ структурной реакции, отмеченный О.В. Копьевым в первые сутки после Э С М , сменяется разнона-
171
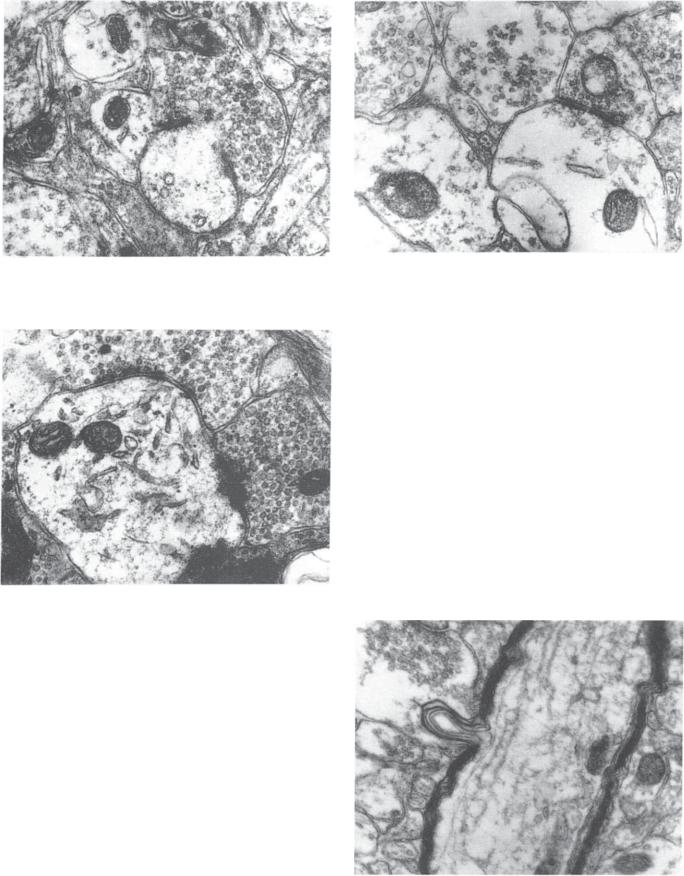
Руководство по черепно мозговой травме
Рис. 5.1 |
. Сенсо-моторная кора через 5 минут после экспери- |
Рис. 5.3. Сенсо-моторная кора через 7 дней после Э С М . Ин- |
ментального сотрясения мозга. Очаговая деструкция аксо-денд- |
вагинация плазматических мембран, прилежащих друг к дру¬ |
|
ритного |
синапса, Х50.000 (материал О.В. Копьева,). |
гу, Х38.000 (см. 9). |
Рис. 5.2. Гипоталамическая область через 2 часа после Э С М . М озаичный характер посттравматических изменений. Гломерула, состоящая из синапсов, отличающихся по количеству синаптических везикул и степени редукции активных зон . Лизис мембранных структур и набухание дендритного окончания, Х40.000 (см. 9).
правленным характером структурно-функциональ- ных изменений в коре полушарий мозга, в диэн - цефальной области и стволе мозга.
В последующие 3—7 дней после Э С М , полностью восстанавливается ультраструктура коры полушарий мозга и через 14 дней уже аналогична контрольному материалу. Тогда как, в диэнцефальной области ультраструктурные изменения сохра¬ няются, а в стволе мозга даже усугубляются.
Через 7 дней нейропиль центрального серого вещества ствола мозга соответствует изменениям, обнаруживаемым в коре полушарий через 2 часа после Э С М (рис. 5—3).
Интересно отметить, что сходные представле¬ ния о патоморфологии сотрясения мозга описал R. Groat с соавторами в 1945 году (см. 69). В экс¬ перименте на приматах, исследуя гистологические препараты мозга через 6—8 дней после травмы, R. Groat выявил значительно более выраженные изменения нейронов в стволе, чем в коре полуша¬ рий мозга.
Даже через 1—4 месяца после Э С М О.В. К о - пьев обнаружил стойкие ультраструктурные изме¬ н е н и я нейронов, глии, нейронально -глиальных отнош ений в диэнцефальной и мезенцефальной областях мозга (рис. 5—4; 5—5; 5—6).
Данные об изменениях аксонов при экспери¬ ментальном сотрясении мозга, т. е. легкой травме головы приводящей к кратковременной потере со¬ знания, проявлением соответствующих неврологи-
Рис. 5.4. Центральное серое вещество водопровода мозга через 14 дней после Э С М . Дезагрегация, выпячивание миелина; лизис трубочек в осевом цилиндре, Х22.000 (см. 9).
172
