
- •654100 – Электроника и микроэлектроника
- •Оглавление
- •Часть первая. Микроэлектроника Глава 1. Общая характеристика микроэлектроники. Принципы функционирования элементов
- •1.1. Основные определения
- •1.2. Классификация изделий микроэлектроники
- •1.3. Физические явления, используемые в интегральной микроэлектронике
- •1.4. Процессы и явления, определяющие функционирование интегральных схем (ис)
- •1.5. Контактные явления в микроэлектронных структурах
- •1.6. Поверхностные явления в полупроводниках
- •1.7. Механизмы переноса носителей заряда
- •Глава 2. Базовые физико-химические методы создания микроэлектронных структур
- •2.1. Очистка поверхности пластин для ис
- •2.2. Получение полупроводниковых монокристаллов методом вытягивания из расплава
- •2.3. Термическое окисление
- •2.4. Эпитаксия
- •2.5. Фотолитография
- •2.6. Диффузия
- •2.7. Ионная имплантация (ионное легирование)
- •2.8. Металлизация
- •Глава 3.Типы подложек интегральных схем, их основные характеристики и процессы изготовления подложек
- •3.1. Изготовление подложек ис
- •3.3. Оптический метод ориентации полупроводниковых пластин
- •3.4. Шлифовка и полировка пластин
- •3.5. Строение нарушенного слоя после механической обработки пластины
- •Глава 4. Технология химической обработки подложек для интегральных микросхем
- •4.1. Механизм химической обработки кремниевых пластин
- •4.2. Термохимическое (газовое) травление
- •4.3. Ионно-плазменное травление
- •Глава 5. Диэлектрические пленки в ис. Методы их получения. Технологии изготовления гибридных ис
- •5.1. Конструктивно-технологические функции диэлектрических плёнок
- •5.2. Формирование плёнок SiO2термическим окислением кремния
- •5.3. Методы получения диэлектрических пленок в технологии гибридных ис
- •5.3.1. Термовакуумное реактивное испарение
- •5.3.2. Анодное окисление
- •5.3.3. Ионно-плазменное окисление
- •Глава 6. Ионное легирование полупроводников
- •6. 1. Общие принципы процесса ионного легирования
- •Для количественной оценки ф согласно (6.1) необходимо знать потенциал φ(u) взаимодействия частиц. В простейшем случае он равен кулоновскому потенциалу. Однако в реальном случае
- •6.2. Отжиг дефектов и электрические свойства слоёв
- •6.3. Импульсный лазерный отжиг
- •6.4. Маскирование в процессах ионного легирования
- •6.5. Маскирование фоторезистами
- •6.6. Маскирование пленками металлов
- •Глава 7. Элионные методы литографических процессов
- •7.1. Электронно-лучевая литография
- •7.2. Рентгенолучевая литография (рлл)
- •7.2.1. Особенности экспонирования в рлл
- •7.2.2. Технология рентгенолитографических процессов
- •7.2.3. Выбор резистов для рлл
- •Глава 8.Пленки в технологии ис, микросборок и коммутационных элементов
- •8.1. Металлические пленки для ис
- •8.2. Технология коммутационных элементов ис
- •8.3. Технология пленочных резисторов
- •8.4. Чистый металл и сплавы
- •8.5. Керметы (микрокомпозиционные пленки)
- •8.6. Изготовление тонкопленочных конденсаторов
- •8.7. Монооксид кремнияSiO
- •8.8. Пятиокись тантала Та2о5
- •8.9. Оксид алюминия Al2o3 и диоксид кремнияSiО2
- •8.10. Диоксид титана ТiО2
- •Глава 9.Монтаж кристаллов ис на носителях. Типы носителей. Особенности сборки ис в корпуса
- •9.1. Конструктивно-технологические варианты монтажа
- •9.2. Изготовление ленточных носителей
- •9.3. Получение внутренних выводов на кристаллах ис
- •9.4. Монтаж кристалла ис на гибкую ленту
- •9.5. Монтаж гибридных ис и микросборок
- •9.6. Особенности сборки сверхбыстродействующих ис и процессоров
- •Глава 10. Технология герметизации ис и мп
- •10.1. Пассивирующие и защитные покрытия ис
- •10.2. Принципы герметизации ис в корпусах
- •10.3. Герметизация ис в металлических корпусах
- •Часть вторая наноэлектроника
- •Глава 11. Теоретические основы наноэлектроники. Одноэлектронные приборы
- •11.1. Проблемы наноэлектроники (одноэлектроники)
- •11.2. Базовая теория кулоновской блокады
- •11.3. "Кулоновская лестница"
- •11.5. Квантовые размерные эффекты
- •11.6. Классификация одноэлектронных приборов
- •11.7. Одноэлектронный прибор на основе сканирующего туннельного микроскопа
- •11.8. Субмикронный вертикальный одноэлектронный транзистор (транзистор Остина)
- •11.9. Применение одноэлектронных приборов
- •Глава 12. Наночастицы и нанокластеры
- •12.1. Свойства наночастиц и их характеристики
- •12.2. Теоретическое моделирование наночастиц (модель ″желе″)
- •12.3. Геометрическая и электронная структуры нанокластеров
- •12.4. Реакционная способность наночастиц
- •12.5. Флуктуационные наноструктуры
- •12.6. Магнитные кластеры
- •12.7. Переход от макро- к нано-
- •12.8. Полупроводниковые наночастицы
- •12.9. Кулоновский взрыв
- •12.10. Молекулярные кластеры
- •12.11. Методы синтеза наночастиц
- •12.12. Химические методы синтеза наночастиц
- •12.13. Термолиз
- •12.14. Импульсные лазерные методы
- •Глава 13.Углеродные наноструктуры
- •13. 1. Природа углеродной связи
- •13.2. Малые углеродные кластеры – с60.
- •13.3. Неуглеродная шарообразная молекула
- •13.4. Углеродные нанотрубки
- •13.4.1. Методы получения нанотрубок
- •13.4.2. Электрические свойства нанотрубок
- •13.4.3. Колебательные свойства нанотрубок
- •13.4.4. Механические свойства нанотрубок
- •13.5. Применение углеродных нанотрубок
- •13.5.1. Полевая эмиссия и экранирование
- •13.5.2. Информационные технологии, электроника
- •13.5.3. Топливные элементы
- •13.5.4. Химические сенсоры
- •13.5.5. Катализ
- •13.5.6. Механическое упрочнение материалов
- •Глава 14.Объемные наноструктурированные материалы: разупорядоченные и кристаллизованные
- •14.1. Методы синтеза разупорядоченных структур
- •14.2. Механизмы разрушения традиционных материалов
- •14.3. Механические свойства наноструктурированных материалов
- •14.4. Многослойные наноструктурированные материалы
- •14.5. Электрические свойства наноструктурированных материалов
- •14.6. Нанокластеры в оптическом материаловедении
- •14.7. Пористый кремний
- •14.8. Упорядоченные наноструктуры
- •14.8.1. Упорядоченные структуры в цеолитах
- •14.8.2. Кристаллы из металлических наночастиц
- •14.8.3. Нанокристаллы для фотоники
- •Глава 15.Наноприборы и наномашины
- •15.1. Микроэлектромеханические устройства (mems)
- •15.2. Наноэлектромеханические системы (nems)
- •15.3. Наноактуаторы
- •15.4. Молекулярные и супрамолекулярные переключатели
- •Библиографический список Основной
- •Физические основы технологии микро- и наноэлектроники
- •620002, Екатеринбург, Мира, 19
- •620002, Екатеринбург, Мира, 19
Глава 5. Диэлектрические пленки в ис. Методы их получения. Технологии изготовления гибридных ис
5.1. Конструктивно-технологические функции диэлектрических плёнок
Создание, развитие и широкое внедрение в промышленность планарной технологии в кремниевых ИС в значительной мере обязаны тому, что на поверхности кремния можно сформировать диэлектрическую пленку, обладающую прекрасными маскирующими свойствами. Для этого наиболее распространенным и качественным диэлектриком остается диоксид кремния.
Использование окисленной поверхности кремния в качестве маски обусловлено химической инертностью диоксида кремния SiO2 по отношению ко многим реагентам. Достаточно сказать, что пленка SiO2 растворима только в плавиковой кислоте и концентрированных растворах щелочей. Однако роль таких пленок не исчерпывается их применением в качестве масок при формировании элементов ИС и защиты этих элементов от влияния внешних воздействий (примесей, влаги, излучения и т.п.) Диэлектрические пленки служат также для электрической изоляции отдельных приборов и коммутационных проводников (особенно многослойных) в ИС.
В зависимости от функций, выполняемых диэлектрическими пленками, к ним предъявляют различные требования. Например, пленки, применяемые в качестве масок, должны обеспечивать:
селективность по отношению к тем или иным технологическим факторам (к растворам, облучению, газам, плазме и т.п.);
отсутствие пор и трещин;
равномерность толщины, структуры физико-химических свойств по площади и глубине маски;
хорошую адгезию к пластине.
Если диэлектрическая пленка применяется в качестве изоляции, то её основными характеристиками являются:
удельное электросопротивление;
тангенс угла диэлектрических потерь (tg δ) ;
диэлектрическая проницаемость (ε);
равномерность и стабильность этих свойств.
5.2. Формирование плёнок SiO2термическим окислением кремния
Наиболее широко применяемым методом формирования плёнок SiO2 является окисление кремния при высоких температурах - термическое окисление.
Плёнки SiO2 толщиной 0,5–1 нм легко образуются уже при комнатной температуре, и такая тонкая пленка оказывается весьма устойчивой. Соответственно при высоких температурах (~1200°C) эта аморфная плёнка кристаллизуется. Переходу из аморфного состояния в кристаллическое способствуют центры кристаллизации, созданные примесями и несовершенством структуры.
В результате реакции кремния с кислородом или водой образуется так называемый термический оксид кремния:
![]() .
(5.1)
.
(5.1)
![]() .
(5.2)
.
(5.2)
Заметим, что скорость реакции (5.2) выше, чем скорость реакции (5.1).
В отличие от термических, анодными диоксидами называются такие, которые получаются в жидком электролите или плазме за счет реакции ионов, движущихся под действием электрического поля:
![]() ,
(5.3)
,
(5.3)
где
![]() - положительный заряд от внешнего
источника.
- положительный заряд от внешнего
источника.
После образования первого слоя SiO2 на поверхности кремния дальнейший рост диоксида может протекать по двум механизмам:
а) диффузия кислорода через поверхностный слой SiO2 к поверхности кремния и реакция на этой поверхности с образованием нового монолитного слоя SiO2;
б) к поверхности диоксида диффундирует кремний и окисляется кислородом.
Однако следует заметить, что второй механизм не играет существенной роли в процессе окисления, так как скорость диффузии кремния в диоксидах на несколько порядков меньше скорости диффузии кислорода.
Таким образом, механизм окисления кремния складывается из нескольких последовательных стадий:
а) диффузии кислорода (или другого окислителя) из газового потока к поверхности кремниевой пластины;
б) адсорбции кислорода этой поверхностью;
в) реакции окисления кремния согласно уравнениям и образования первоначального слоя SiO2;
г) диффузии окислителя через этот слой к поверхности кремния Si, где и протекает следующая реакция окисления.

Рис.5.1. Схема процесса последовательного окисления Si
Самой медленной из указанных стадий является диффузия кислорода через слой диоксида. Следовательно, она и будет лимитировать скорость процесса в целом.
Для стационарного процесса скорости потоков кислорода во всех стадиях должны быть равны. Поскольку адсорбция происходит мгновенно, то j1= j2= j3 , где j1 – скорость массопередачи кислорода из газового потока к поверхности пластины; j2 – диффузии кислорода через окисленный слой к поверхности кремния; j3 – скорость реакции окисления Si.
Согласно закону Фика, для потока окислителя можно записать:
j
2
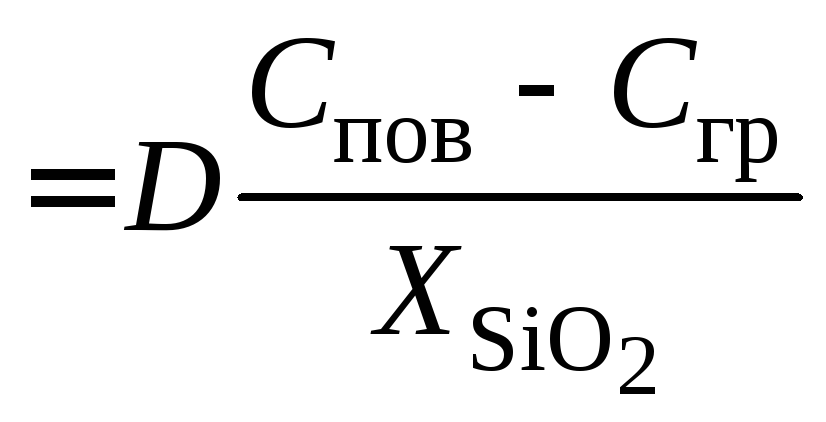 ,
(5.4)
,
(5.4)
где D
– коэффициент диффузии окислителя в
слое диоксида;
![]() ,
,![]() – соответственно концентрации О2
на поверхности пластины (SiO2)
и границе раздела ″кремний-диоксид″;
– соответственно концентрации О2
на поверхности пластины (SiO2)
и границе раздела ″кремний-диоксид″;
![]() –
толщина слоя диоксида (формально глубина
диффузии).
–
толщина слоя диоксида (формально глубина
диффузии).
Скорость взаимодействия кремния с кислородом по уравнению (5.1) описывается реакцией первого порядка:
j3
![]() ,
где k
– постоянная скорости реакции окисления
кремния.
,
где k
– постоянная скорости реакции окисления
кремния.
Поскольку для стационарного процесса j2 = j3 , то
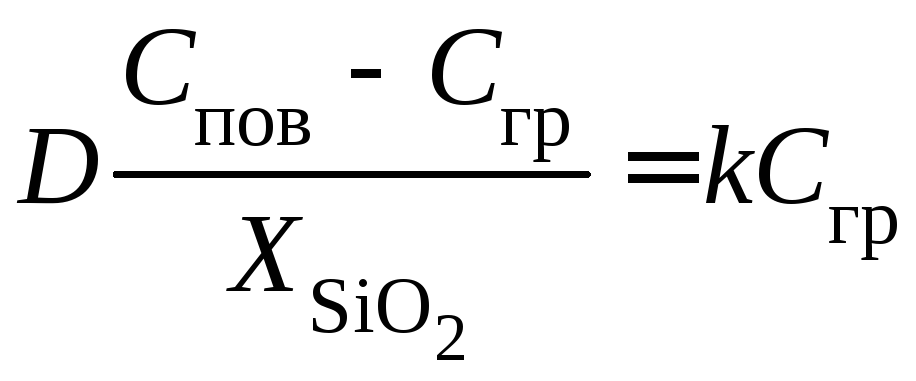
![]()
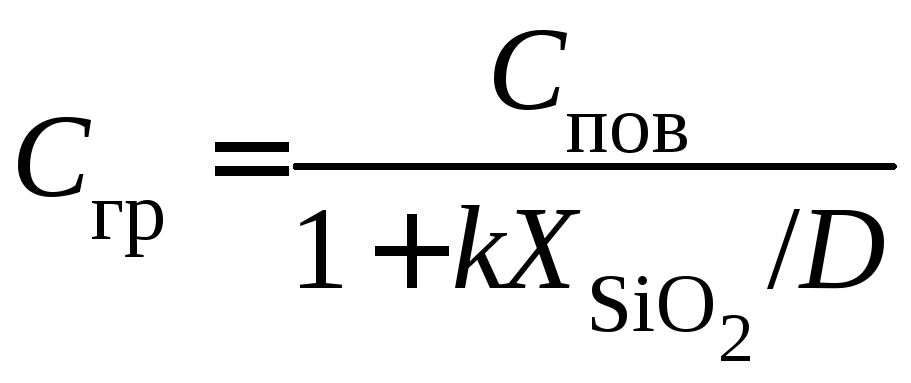 .
(5.5)
.
(5.5)
Для потока окислителя, достигающего поверхность раздела между диоксидом и кремнием:
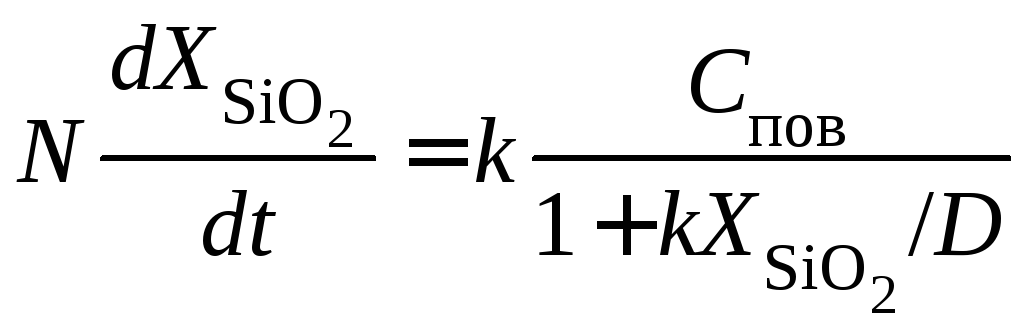 ,
(5.6)
,
(5.6)
где
![]() – число
молекул окислителя в единицу объёма
диоксида,
– число
молекул окислителя в единицу объёма
диоксида,
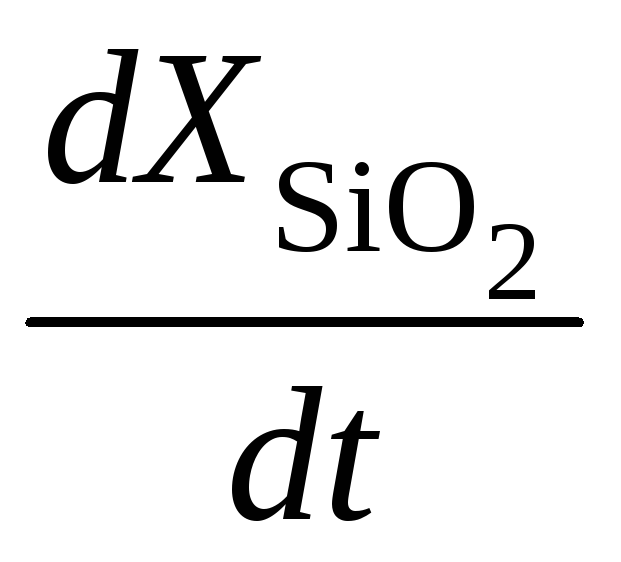 – скорость роста диоксида.
– скорость роста диоксида.
Пусть при t
= 0
![]() .
Величина
.
Величина![]() – есть толщина диоксида, полученного
при предыдущем акте окисления, то есть
окисление осуществляется в несколько
этапов. Тогда из (5.6) следует
– есть толщина диоксида, полученного
при предыдущем акте окисления, то есть
окисление осуществляется в несколько
этапов. Тогда из (5.6) следует
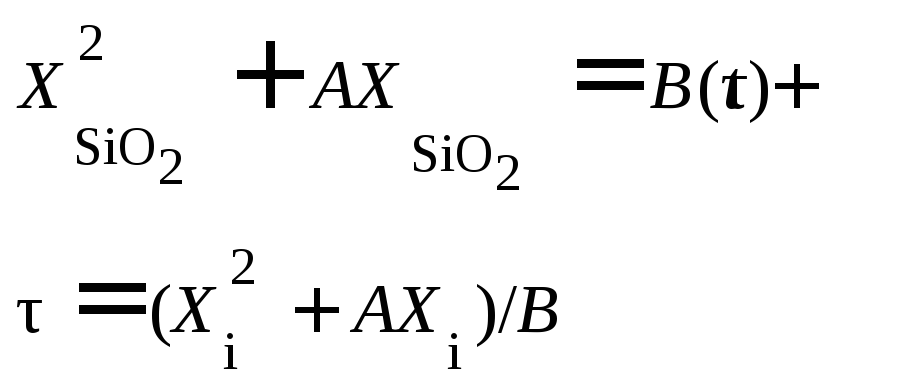
 ,
(5.7)
,
(5.7)
где
![]() ;
;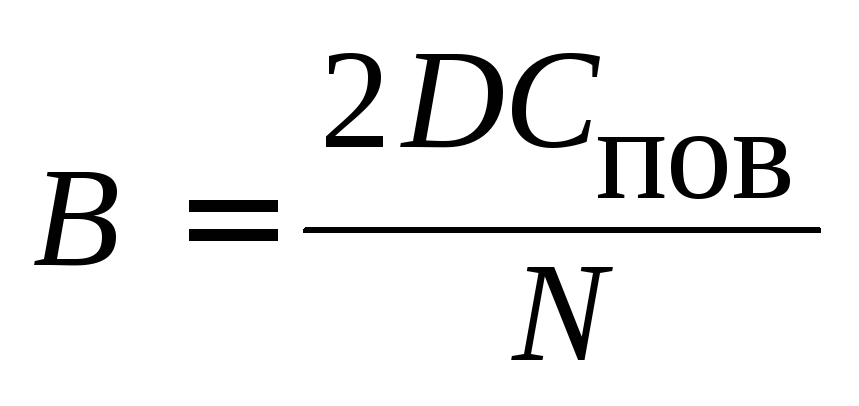 .
.
Решая эту систему, получаем:
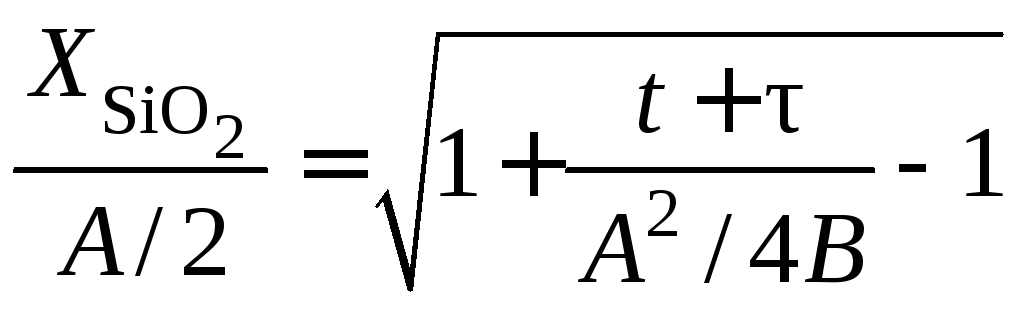 .
(5.8)
.
(5.8)
Уравнение имеет два предельных случая:
Время окисления велико:
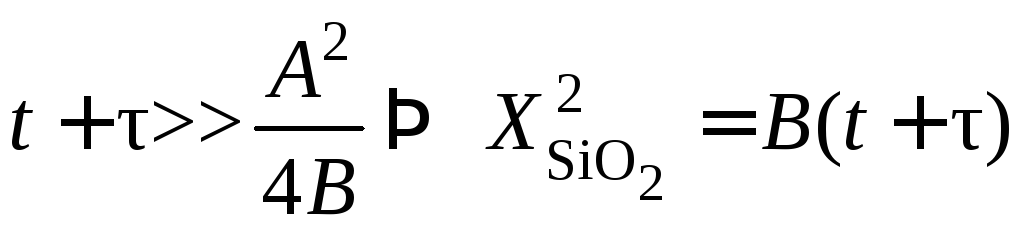 ,
гдеВ =
const
– постоянная параболического закона
окисления.
,
гдеВ =
const
– постоянная параболического закона
окисления.Время окисления мало:
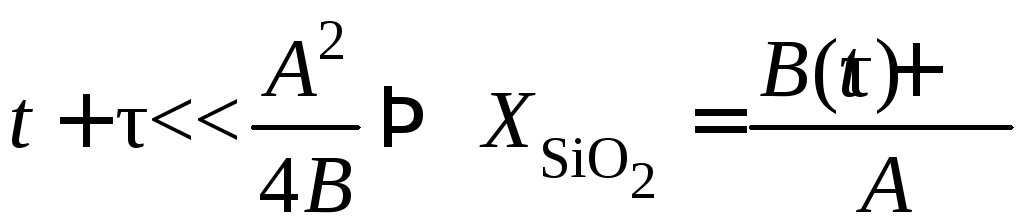 ,
гдеВ/А =
const
– постоянная линейного закона окисления.
,
гдеВ/А =
const
– постоянная линейного закона окисления.
t+τ
Рис. 5.2. Экспериментальная зависимость толщины
оксида кремния от времени окисления
lnB

Рис. 5.3. Экспериментальная зависимость параметра В от температуры
Рассмотренная модель термического окисления справедлива как для окисления в чистом ″сухом″ кислороде, так и в чистых парах воды. На практике при термическом окислении обычно используется смесь кислорода и паров воды.
Следует отметить, что количественный анализ процесса окисления во влажном кислороде довольно сложен из-за большого числа возможных реакций в системе и одновременной диффузии в оксидном слое двух окислителей – кислорода и водяных паров. Кроме того, пленки SiO2, полученные в парах воды и во влажном кислороде, обладают худшими электрическими и защитными свойствами, чем пленки, полученные в ″сухом″ кислороде.
Химическое осаждение диэлектрических пленок из газовой фазы наиболее распространено на практике вследствие простоты, универсальности и высокой производительности процесса. Простота процесса объясняется простотой оборудования и доступностью (недефицитностью) исходных материалов, универсальностью (возможностью осаждать пленки различных материалов), высокой производительностью (значительно большей скоростью химических реакций осаждения по сравнению с процессом окисления).
Для окисления пленок SiO2 используются следующие реакции:
 –пиролиз (T
= 600-8000С,
R
– органические радикалы, например
C2H5,
CH3);
–пиролиз (T
= 600-8000С,
R
– органические радикалы, например
C2H5,
CH3); –окисление (Т =
250-4000С);
–окисление (Т =
250-4000С); –гидролиз (Т =
200-2500С).
–гидролиз (Т =
200-2500С).
Для получения SiO2-пленок по реакции пиролиза могут использоваться и другие этоксилианы, представляющие собой продукты замещения в молекуле SiH4 атомов водорода на группу OC2H5. При этом степень замещения может изменяться от 0 до 4. Скорость роста пленок SiO2 по такому методу замещения при Т >700°C достаточно велика, что позволяет получать слои достаточно высокого качества толщиной в несколько микрон всего за 10-15 минут.
Использование температур ниже 700°С не рекомендовано, поскольку в этом случае пиролиз оказывается неполным и, как правило, пленки SiO2 оказываются загрязненными промежуточными продуктами разложения, которые содержат неконтролируемые донорные и акцепторные примеси.
В отличие от реакции пиролиза (1), реакции окисления (2) и гидролиза (3) протекают без органических остатков и в результате формируются очень чистые пленки. Вместе с тем низкие температуры также крайне не желательны. Поэтому основным требованием к реакциям окисления и гидролиза является жесткий контроль температуры и регулировка концентрации газовой фазы на поверхности пластин.
Обычно скорость роста пленки растет линейно с увеличением скорости потока силана. Однако при повышении температуры скорость осаждения SiO2 растет очень резко и практически неконтролируемо. Поэтому производят разбавление газа, например кислородом, и тогда зависимость скорости роста SiO2 от скорости потока силана принимает следующий вид, показанный на рис. 5.4:

Рис. 5.4. Зависимость скорости роста пленки SiO2 с увеличением
скорости потока газа (силана SiН4)
Процесс, описываемый реакцией гидролиза (3), начинает протекать уже при комнатной температуре, и образующийся в парах диоксид кремния осаждается на поверхность в виде достаточно рыхлых образований. Как и в предыдущем случае, необходимо поддерживать температуру на уровне 500-5500С и подавать пары SiCl4 (SiF4) непосредственно на поверхность пластины.
Достоинством процесса осаждения слоев SiO2 по реакциям окисления (2) и гидролиза (3) является возможность их сочетания с эпитаксиальным наращиванием кремния в одном аппарате и высокая чистота формируемых пленок.
Помимо оксида кремния в технологии ИС используются нитрид кремния Si3N4, оксид алюминия Al2O3, диоксид TiO2, пятиокись тантала Ta2O5. Например, формирование пленок Si3N4 прямым азотированием пластин кремния практически не применяется из-за высоких температур (~13000С) процесса и чрезвычайно малых скоростей формирования пленок. Как и при создании слоев SiO2, наилучшие результаты получаются при использовании газофазных реакций.
Слои оксида алюминия обычно получают анодным окислением алюминия или осаждением Al2O3 из металлоорганических соединений алюминия, как и в случае SiO2.
