
- •654100 – Электроника и микроэлектроника
- •Оглавление
- •Часть первая. Микроэлектроника Глава 1. Общая характеристика микроэлектроники. Принципы функционирования элементов
- •1.1. Основные определения
- •1.2. Классификация изделий микроэлектроники
- •1.3. Физические явления, используемые в интегральной микроэлектронике
- •1.4. Процессы и явления, определяющие функционирование интегральных схем (ис)
- •1.5. Контактные явления в микроэлектронных структурах
- •1.6. Поверхностные явления в полупроводниках
- •1.7. Механизмы переноса носителей заряда
- •Глава 2. Базовые физико-химические методы создания микроэлектронных структур
- •2.1. Очистка поверхности пластин для ис
- •2.2. Получение полупроводниковых монокристаллов методом вытягивания из расплава
- •2.3. Термическое окисление
- •2.4. Эпитаксия
- •2.5. Фотолитография
- •2.6. Диффузия
- •2.7. Ионная имплантация (ионное легирование)
- •2.8. Металлизация
- •Глава 3.Типы подложек интегральных схем, их основные характеристики и процессы изготовления подложек
- •3.1. Изготовление подложек ис
- •3.3. Оптический метод ориентации полупроводниковых пластин
- •3.4. Шлифовка и полировка пластин
- •3.5. Строение нарушенного слоя после механической обработки пластины
- •Глава 4. Технология химической обработки подложек для интегральных микросхем
- •4.1. Механизм химической обработки кремниевых пластин
- •4.2. Термохимическое (газовое) травление
- •4.3. Ионно-плазменное травление
- •Глава 5. Диэлектрические пленки в ис. Методы их получения. Технологии изготовления гибридных ис
- •5.1. Конструктивно-технологические функции диэлектрических плёнок
- •5.2. Формирование плёнок SiO2термическим окислением кремния
- •5.3. Методы получения диэлектрических пленок в технологии гибридных ис
- •5.3.1. Термовакуумное реактивное испарение
- •5.3.2. Анодное окисление
- •5.3.3. Ионно-плазменное окисление
- •Глава 6. Ионное легирование полупроводников
- •6. 1. Общие принципы процесса ионного легирования
- •Для количественной оценки ф согласно (6.1) необходимо знать потенциал φ(u) взаимодействия частиц. В простейшем случае он равен кулоновскому потенциалу. Однако в реальном случае
- •6.2. Отжиг дефектов и электрические свойства слоёв
- •6.3. Импульсный лазерный отжиг
- •6.4. Маскирование в процессах ионного легирования
- •6.5. Маскирование фоторезистами
- •6.6. Маскирование пленками металлов
- •Глава 7. Элионные методы литографических процессов
- •7.1. Электронно-лучевая литография
- •7.2. Рентгенолучевая литография (рлл)
- •7.2.1. Особенности экспонирования в рлл
- •7.2.2. Технология рентгенолитографических процессов
- •7.2.3. Выбор резистов для рлл
- •Глава 8.Пленки в технологии ис, микросборок и коммутационных элементов
- •8.1. Металлические пленки для ис
- •8.2. Технология коммутационных элементов ис
- •8.3. Технология пленочных резисторов
- •8.4. Чистый металл и сплавы
- •8.5. Керметы (микрокомпозиционные пленки)
- •8.6. Изготовление тонкопленочных конденсаторов
- •8.7. Монооксид кремнияSiO
- •8.8. Пятиокись тантала Та2о5
- •8.9. Оксид алюминия Al2o3 и диоксид кремнияSiО2
- •8.10. Диоксид титана ТiО2
- •Глава 9.Монтаж кристаллов ис на носителях. Типы носителей. Особенности сборки ис в корпуса
- •9.1. Конструктивно-технологические варианты монтажа
- •9.2. Изготовление ленточных носителей
- •9.3. Получение внутренних выводов на кристаллах ис
- •9.4. Монтаж кристалла ис на гибкую ленту
- •9.5. Монтаж гибридных ис и микросборок
- •9.6. Особенности сборки сверхбыстродействующих ис и процессоров
- •Глава 10. Технология герметизации ис и мп
- •10.1. Пассивирующие и защитные покрытия ис
- •10.2. Принципы герметизации ис в корпусах
- •10.3. Герметизация ис в металлических корпусах
- •Часть вторая наноэлектроника
- •Глава 11. Теоретические основы наноэлектроники. Одноэлектронные приборы
- •11.1. Проблемы наноэлектроники (одноэлектроники)
- •11.2. Базовая теория кулоновской блокады
- •11.3. "Кулоновская лестница"
- •11.5. Квантовые размерные эффекты
- •11.6. Классификация одноэлектронных приборов
- •11.7. Одноэлектронный прибор на основе сканирующего туннельного микроскопа
- •11.8. Субмикронный вертикальный одноэлектронный транзистор (транзистор Остина)
- •11.9. Применение одноэлектронных приборов
- •Глава 12. Наночастицы и нанокластеры
- •12.1. Свойства наночастиц и их характеристики
- •12.2. Теоретическое моделирование наночастиц (модель ″желе″)
- •12.3. Геометрическая и электронная структуры нанокластеров
- •12.4. Реакционная способность наночастиц
- •12.5. Флуктуационные наноструктуры
- •12.6. Магнитные кластеры
- •12.7. Переход от макро- к нано-
- •12.8. Полупроводниковые наночастицы
- •12.9. Кулоновский взрыв
- •12.10. Молекулярные кластеры
- •12.11. Методы синтеза наночастиц
- •12.12. Химические методы синтеза наночастиц
- •12.13. Термолиз
- •12.14. Импульсные лазерные методы
- •Глава 13.Углеродные наноструктуры
- •13. 1. Природа углеродной связи
- •13.2. Малые углеродные кластеры – с60.
- •13.3. Неуглеродная шарообразная молекула
- •13.4. Углеродные нанотрубки
- •13.4.1. Методы получения нанотрубок
- •13.4.2. Электрические свойства нанотрубок
- •13.4.3. Колебательные свойства нанотрубок
- •13.4.4. Механические свойства нанотрубок
- •13.5. Применение углеродных нанотрубок
- •13.5.1. Полевая эмиссия и экранирование
- •13.5.2. Информационные технологии, электроника
- •13.5.3. Топливные элементы
- •13.5.4. Химические сенсоры
- •13.5.5. Катализ
- •13.5.6. Механическое упрочнение материалов
- •Глава 14.Объемные наноструктурированные материалы: разупорядоченные и кристаллизованные
- •14.1. Методы синтеза разупорядоченных структур
- •14.2. Механизмы разрушения традиционных материалов
- •14.3. Механические свойства наноструктурированных материалов
- •14.4. Многослойные наноструктурированные материалы
- •14.5. Электрические свойства наноструктурированных материалов
- •14.6. Нанокластеры в оптическом материаловедении
- •14.7. Пористый кремний
- •14.8. Упорядоченные наноструктуры
- •14.8.1. Упорядоченные структуры в цеолитах
- •14.8.2. Кристаллы из металлических наночастиц
- •14.8.3. Нанокристаллы для фотоники
- •Глава 15.Наноприборы и наномашины
- •15.1. Микроэлектромеханические устройства (mems)
- •15.2. Наноэлектромеханические системы (nems)
- •15.3. Наноактуаторы
- •15.4. Молекулярные и супрамолекулярные переключатели
- •Библиографический список Основной
- •Физические основы технологии микро- и наноэлектроники
- •620002, Екатеринбург, Мира, 19
- •620002, Екатеринбург, Мира, 19
Глава 13.Углеродные наноструктуры
13. 1. Природа углеродной связи
Рассмотрим особенности углеродной связи и электронную структуру атома углерода. В нем имеется шесть электронов, которые в невозбужденном состоянии находятся на низших энергетических уровнях. Когда атом углерода связан в молекуле с другими атомами, его электронная структура выглядит так: (1s)2(2s)(2px)(2py)(2pz).
На нижнем уровне – 1s – находятся два электрона с противоположно направленными спинами. Распределение заряда электрона в s-состоянии сферически симметрично, и 1s-электроны не принимают участие в образовании химических связей. Остальные четыре электрона находятся на уровне с n = 2: один на сферически симметричной s-орбитали, а остальные три на рx-, рy-, рz-орбиталях. Распределение заряда на р-орбиталях имеют сильно удлиненную в одном направлении форму:
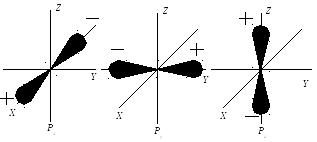
Рис. 13.1. Распределение заряда на р-орбиталях атома углерода
Внешняя s-орбиталь и 3р-орбитали формируют химические связи атома углерода с другими атомами. Распределение зарядов, связанных с этими орбиталями, смешивается (перекрывается) с распределением заряда каждого связанного с углеродом атома. Однако, если бы все было так просто, то, например, молекула метана CH4 имела бы связи Н-С, располагающиеся под углом 90о. В действительности же структура молекулы метана обладает тетраэдрической структурой. Этот факт объясняется в рамках концепции гибридизации связей.
В атоме углерода
разность энергий между 2s-
и 2р-уровнями
мала, что позволяет волновым функциям
2s-состояний
смешиваться с одной или несколькими
волновыми функциями 2р-состояния.
Ненормированная волновая функция ψ
валентного состояния может быть записана
в виде:
![]() ,
гдер
– смесь рi
числа орбиталей,
,
гдер
– смесь рi
числа орбиталей,
![]() –
коэффициент смешивания.
–
коэффициент смешивания.
При такой гибридизации направление лепестков р-орбиталей и углы между ними меняются. Углы зависят от относительного коэффициента смешивания λ числа р-состояний с s-состояниями. Большинство углов между связями углерода в органических молекулах имеют значение 180о, 120о, 109о28’.
Твердый углерод имеет две основные формы, называемые аллотропными модификациями, – алмаз и графит. Эти модификации стабильны при комнатной температуре. Алмаз состоит из атомов углерода, тетраэдрически связанных друг с другом посредством sр3-гибридизованных связей, образующих трехмерную сетку. Графит имеет слоистую структуру, где каждый слой образован шестиугольниками из атомов углерода, связанных посредством sр2-гибридизации.
13.2. Малые углеродные кластеры – с60.
Для получения кластеров углерода может быть использовано лазерное испарение подложки в потоке гелия с помощью установки, изображенной на рис. 12.1. В этом случае пучок электронейтральных кластеров фотоионизируется ультрафиолетовым лазером и анализируется масс-спектрометром. В результате получается спектр, подобный тому, что изображен на рис. 13.2.
Видно, что в спектре выделяются пики атомов для фуллеренов С60 и С70. Используя метод молекулярных орбиталей, устананавливают, что линейная структура кластеров с sр-гибридизацией наблюдается при нечетных значениях N, а циклическая – при четных. Другие пики, которые заметны на масс-спектре, видимо, имеют большую стабильность структуры. Открытие молекулы, похожей на футбольный мяч, явилось в некотором смысле случайным результатом исследования природы материи в межзвездном пространстве. Несмотря на то, что молекулу С60, похожую на футбольный мяч, химики-теоретики предсказывали много лет назад, никаких доказательств ее существования обнаружено не было. И только благодаря исследованиям Хоффмана и Кратчмера четыре полосы поглощения осажденного ״графитного״ вещества из ״межзвездной пыли״ достаточно точно соответствовали предсказаниям для молекулы С60. Собственно фуллереном молекула С60 была названа по имени архитектора и изобретателя Р.Бакминстера Фуллера, построившего сооружение, напоминающее структуру С60.

Рис. 13.2. Масс-спектр углерода
Первоначально молекулу назвали бакминстерфуллереном, но название было настолько неудобно, что его сократили просто до фуллерена. Геометрия молекулы фуллерена ближе к форме футбольного мяча, состоящего из 5- и 6-гранных фасеток. Эти шарообразные молекулы могут соединяться друг с другом в твердом теле с образованием ГЦК кристаллической решетки.

Рис. 13.3. Элементарная ячейка кристаллической решетки
фуллерена С60, легированного щелочными металлами
На рис. 13.3 изображена элементарная ячейка кристаллической решетки фуллерена С60 (большие шары), легированного щелочными атомами (темные шары). Расстояние между центрами ближайших молекул С60 в такой решетке составляет по теоретическим оценкам порядка 1 нм. Кстати тот факт, что в структуре фуллерена 26% объема элементарной ячейки пустует, позволяет легко легировать фуллерен атомами щелочных металлов: Li, Na, K, Rb, Cs.
