
- •Глава 3. Функциональные производные алканов
- •3.1. ОбщноСть Химических свойств
- •3.1.1. Реакции нуклеофильного замещения
- •3.1.2. Реакции отщепления (элиминирования)
- •3.2. Галогеналканы
- •3.2.1. Классификация, номенклатура, изомерия
- •3.2.2. Строение и свойства
- •3.2.3. Способы получения
- •3.2.4. Полигалогеналканы
- •3.2.5. Физиологическая роль и Важнейшие представители
- •3.3. Насыщенные спирты
- •3.3.1. Классификация, номенклатура, изомерия
- •3.3.2. Строение и физические свойства
- •3.3.3. Химические свойства
- •3.3.4. Способы получения
- •3.3.5. Многоатомные спирты
- •3.3.6. Физиологическое действие
- •3.3.7. Важнейшие представители
- •3.4. Простые насыщенные эфиры
- •3.4.1. Номенклатура и изомерия
- •3.4.2. Физические и химические свойства
- •3.4.3. Способы получения
- •3.4.4. Циклические простые эфиры
- •3.4.5. Физиологическая роль и Важнейшие представители
- •3.5. Эфиры минеральных кислот
- •3.5.1. Эфиры серной кислоты
- •3.5.2. Эфиры фосфорной кислоты
- •3.6. Тиоспирты и тиоэфиры
- •3.7. Насыщенные амины
- •3.7.1. Классификация, номенклатура, изомерия
- •3.7.2. Физические свойства
- •3.7.3. Строение и химические свойства
- •3.7.4. Способы получения
- •3.7.5. Физиологическая роль и Важнейшие представители
- •3.8. Нитроалканы
- •3.8.1. Строение
- •3.8.2. Свойства
- •3.8.3. Способы получения
- •3.8.4. Физиологическое действие и Важнейшие представители
- •3.9. Кремний-, фосфор- и мышьякорганические соединения
- •3.9.1. Кремнийорганические соединения
- •3.9.2. Фосфорорганические соединения
- •3.9.3. Мышьякорганические соединения
- •Вопросы и упражнения
3.4. Простые насыщенные эфиры
в молекулах насыщенных простых эфиров два углеводородных радикала соединены через атом кислорода: R-O-R. Другими словами, их можно рассматривать как органические производные воды, в молекуле которой оба атома водорода замещены предельными углеводородными радикалами. Если эти углеводородные радикалы неодинаковы (R R), то такие эфиры называют смешанными.
3.4.1. Номенклатура и изомерия
для названия простых эфиров применяются обычно радикало-функциональная и заместительная номенклатуры ИЮПАК, но могут применяться и другие виды номенклатур (например, «а»-номенклатура — гл. 1.5.3).
Название соединения по радикало-функциональной номенклатуре состоит из прилагательного, образованного от названий углеводородных радикалов, и существительного «эфир». Например:
|
CH3-О-СН3
|
— |
диметиловый эфир, |
|
C2H5-О-СН3
|
— |
метилэтиловый эфир. |
В заместительной номенклатуре в качестве родоначальной структуры выбирается одна из двух углеродных цепей, связанных с атомом кислорода (подробнее о выборе родоначальной структуры — гл. 1.5.1). Атом кислорода с другим углеводородным радикалом (-О-R) является заместителем, название которого присутствует в названии эфира в виде приставки. Названия таким заместителям даются по общим правилам заместительной номенклатуры. Примеры:
|
|
— |
метоксиэтан, |
|
|
|
|
|
|
— |
2-метил-1-пропоксипропан, |
|
|
— |
3-метил-2-метоксибутан. |
Из тривиальных названий для широко распространённых насыщенных эфиров с одной эфирной группой общеупотребительными являются тривиальные названия только одного из них. Это серный, или медицинский, эфир С2Н5ОС2Н5. Среди ди- и полиэфиров используются следующие тривиальные названия: СН3ОСН2СН2ОСН2СН2ОСН3 — диглим (диметиловый эфир диэтиленгликоля), а моноэфиры этиленгликоля имеют общее название — целлозольвы (метилцеллозольв СН3ОСН2СН2ОН, этилцеллозольв С2Н5ОСН2СН2ОН).
Все виды изомерии, характерные для рассмотренных выше соединений с -связями, существуют и для насыщенных простых эфиров. Кроме того, здесь встречается метамерия — разновидность межклассовой структурной изомерии. Другими словами, простые эфиры изомерны одноатомным спиртам. (Их брутто-формулы одинаковы — СnН2n+2О). Так, диметиловый эфир СН3ОCН3 изомерен этиловому спирту, а упомянутый выше 2-метокси-3-метилбутан изомерен гексиловым спиртам С6Н13ОН.
3.4.2. Физические и химические свойства
п ростые
эфиры — полярные соединения. Валентный
угол СОС
составляет 109—112.
Это влияет на их растворимость в воде
— простые эфиры значительно лучше
растворимы, чем незамещённые углеводороды.
Это объясняется и возможностью образования
водородных связей между молекулами
эфира и воды:
ростые
эфиры — полярные соединения. Валентный
угол СОС
составляет 109—112.
Это влияет на их растворимость в воде
— простые эфиры значительно лучше
растворимы, чем незамещённые углеводороды.
Это объясняется и возможностью образования
водородных связей между молекулами
эфира и воды:
![]() .
.
Но температуры кипения их мало отличаются от температур кипения соответствующих углеводородов, так как водородные связи между самими молекулами эфира невозможны (нет подвижных атомов водорода).
простые эфиры в обычных условиях — инертные химические соединения. Но они могут в жёстких условиях вступать в реакции нуклеофильного замещения (ацидолиз простых эфиров): при повышенном давлении и высокой температуре простые эфиры расщепляются под действием H2SO4, HBr, HI:
R-O-R + HI R-I + R-OH
Если один из углеводородных радикалов R — третичный, то образуется третичный алкилйодид, механизм реакции — SN1:

В остальных случаях реакция протекает преимущественно по SN2-механизму, и, значит, при ацидолизе метилалкиловых эфиров образуется йодометан и соответствующий спирт:

При этом йодоводородная кислота значительно реакционноспособнее, чем бромоводородная, а хлороводородная для этих целей не применяется вовсе из-за её низкой активности. Реакцию с йодоводородной кислотой проводят в среде ледяной уксусной кислоты.
Расщепление метил- и этилалкиловых эфиров посредством HI используют для количественного определения метокси- и этоксигрупп (метод Цейзеля*). Для этого алкоксиалкан нагревают с концентрированной йодоводородной кислотой до 373 К — образуется CH3I или C2H5I. Метод основан на определении йода либо по количеству осаждённого AgI при пропускании йодметана (или йодэтана) через раствор AgNO3, либо по количеству выделившегося I2 при окислении. Метод используют для определения алкоксигрупп в углеводах и алкалоидах.
Среди реакций расщепления связи C–О, кроме ацидолиза, можно отметить ещё и взаимодействие со щелочными металлами:
R-О-R + 2Na R-O-Na + R-Na
Механизм реакции, скорее всего, радикальный.
Так же как и спирты, простые эфиры обладают оснóвными свойствами — могут образовывать с кислотами оксониевые соли:

хлорид диалкилоксония
При этом электронодонорные свойства у эфиров выражены сильнее, чем у спиртов из-за электронодонорного действия двух алкильных групп при атоме кислорода. Но в целом эфиры, как и спирты, — основания слабые, и поэтому оксониевые соли в присутствии воды полностью гидролизованы. Например, диэтиловый эфир начинает протонироваться в ощутимых количествах только в растворе 30—50%-й серной кислоты.
Простые эфиры могут вступать в радикальные реакции по -углеродному атому. Это могут быть реакции хлорирования. Но более значимы для практики реакции окисления:
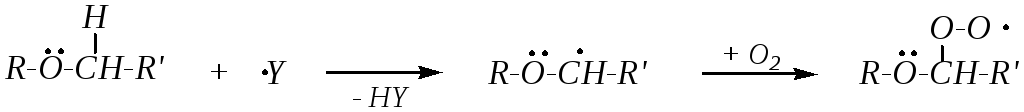
инициирующая
частица

Свободные алкоксиалкильные радикалы более стабильны, чем алкильные, вследствие делокализации неспаренного электрона при взаимодействии с неподелённой электронной парой кислорода. И так как в молекулах простых эфиров имеется два -углеродных атома (с разных сторон от атома кислорода), то реакция идёт по тому направлению, которое приводит к образованию более стабильного радикала.
Продуктами окисления являются гидропероксиды — нестабильные и взрывчатые соединения. При хранении диалкиловых эфиров с доступом воздуха, особенно на солнечном свету в прозрачных бутылках, всегда образуется примесь гидропероксидов. Гидропероксиды представляют собой малолетучие маслянистые жидкости с острым запахом. Поэтому перед использованием эфиров необходимо делать пробу на наличие в них пероксидных соединений, добавляя сульфат железа (II) и роданид калия (или аммония). Пероксидные соединения разрушают (за счёт восстановления) при обработке эфиров натрием, солями железа (II) или марганца (II).

 СН3CH2-ОCН3
СН3CH2-ОCН3
