
- •Міністерство освіти і науки, молоді та спорту україни
- •Лекція № 3. Другий закон термодинаміки. . . . . . . . . . . . . 11
- •Передмова
- •Фізичну хімію підрозділяють на декілька основних розділів, які характеризують напрямок розвитку цієї науки та її предмет.
- •1.2 Теоретичні методи дослідження фізичної хімії
- •1.3 Експериментальні методи дослідження будови речовин
- •2.1 Основні поняття хімічної термодинаміки
- •2.2 Перший закон термодинаміки
- •2.4 Калориметрія
- •Лекція № 3. Другий закон термодинаміки
- •Лекція № 4. Термодинаміка хімічної рівноваги
- •4.1 Хімічна рівновага
- •Лекція № 5. Термодинаміка фазових переходів
- •5.1 Фазові рівноваги
- •5.2 Хімічний потенціал речовин
- •5.3 Фізико-хімічний аналіз
- •5.4Діаграма стану води
- •Лекція № 6. Термічний аналіз
- •6.1 Побудова діаграм стану систем за кривими охолодження
- •6.2 Діаграми стану систем, компоненти яких утворюють твердий розчин
- •Лекція № 7. 3агальна характеристика розчинів
- •7.1 Розчинність речовин
- •7.2 Способи вираження концентрації розчинів
- •7.3 Взаємна розчинність рідин
- •7.2 Екстракція
- •8.1 Розчини газів у рідинах
- •8.2 Закон Рауля
- •8.3 Осмос
- •9.1 Теорія електролітичної дисоціації
- •9.2 Водневий показник
- •9.3 Фізико-хімічні властивості розчинів електролітів
- •9.4 Теорія сильних електролітів
- •10.1 Механізм виникнення електродного потенціалу
- •10.2 Класифікація електродів
- •10.3 Потенціометричний метод дослідження
- •10.4 Кондуктометричний метод дослідження
- •11.1 Електрохімічні елементи
- •11.2 Класифікація електрохімічних елементів
- •11.3 Хімічні джерела електричної енергії
- •12.1 Швидкість хімічних реакцій
- •12.2 Кінетична класифікація хімічних реакцій
- •12.3 Кінетичні рівняння хімічних реакцій і-го і іі-го порядків
- •12.4 Методи визначення порядку хімічних реакцій
- •13.1 Паралельні і послідовні хімічні реакції
- •13.2 Ланцюгові хімічні реакції
- •13.3 Фотохімічні реакції
- •14.1 Загальні властивості каталізаторів
- •14.2 Гомогенний каталіз
- •14.3 Гетерогенний каталіз
- •14.4 Ферментативний каталіз
- •15.1 Поверхневий натяг
- •15.2 Поверхнево-активні речовини
- •15.3 Адсорбція пар на поверхні рідин
- •16.1 Теорія фізичної адсорбції Ленгмюра
- •Під час полімолекулярній адсорбції
- •16.3 Іонообмінна адсорбція
- •17.3 Флотація
- •17.4 Адсорбція в поруватих тілах
- •18.1 Класифікація дисперсних систем
- •18.2 Методи одержання дисперсних систем
- •18.3 Молекулярно-кінетичні властивості золів
- •18.4 Оптичні властивості дисперсних систем
- •19.2 Будова міцел ліофобних золів
- •19.3 Подвійний електричний шар на поверхні часточок
- •19.4 Електрокінетичний потенціал
- •20.1 Явище коагуляції золів
- •20.3 Захист золів від коагуляції
- •20.4 Пептизація
- •21.1 Колоїдні поверхнево-активні речовини
- •21.2 Міцелоутворення в ліофільних системах
- •21.3 Гідрофільно-ліпофільний баланс
- •21.4 Солюбілізація
- •22.1 Класифікація емульсій
- •22.2 Методи визначення типу емульсій
- •22.3 Емульгатори
- •22.4 Руйнування емульсій
- •22.5 Застосування емульсій в харчовій промисловості
- •23.2 Суспензії
- •23.3 Аерозолі
- •23.4 Порошки
- •24.1 Класифікація вмс
- •24.2 Фізичний стан полімерів
- •24.3 Фракціонування вмс
- •25.1 Механізм процесу набрякання вмс
- •25.2 Характеристики процесу набрякання
- •25.3 Термодинаміка процесів набрякання вмс
- •26.1 Класифікація поліелектролітів
- •26.2 Поліамфоліти
- •26.3 Властивості розчинів поліелектролітів
- •26.4 Висолювання і денатурація білків
- •27.1 Закон Ньютона
- •27.2 Віскозиметрія
- •27.3 В’язкість структурованих систем
- •27.4 Драглі
- •Рекомендована до дисципліни література
- •Навчальне видання
- •Для студентів напряму підготовки
- •6.051701 «Харчові технології та інженерія» піднапряму „Харчова інженерія”
13.1 Паралельні і послідовні хімічні реакції
Складними називають хімічні реакції, перебіг яких не можна описати одним стехіометричним рівнянням. Більшість хімічних реакцій – це багатостадійні процеси. Теорія кінетики складних реакцій ґрунтується на принципі незалежності перебігу окремих стадій реакції, тобто кожна стадія має таку ж швидкість, з якою вона перебігала би за відсутності інших стадій.
Паралельними називають реакції, що одночасно перебігають за декількома напрямками з утворенням різних продуктів реакції. Розглянемо найпростіший тип паралельної реакції – розклад речовини А. Реакція складається з двох простих реакцій І-го порядку:
k1
АВ – реакція перетворення речовини А в речовину В з константою швидкості k1
k2
АD – реакція перетворення речовини А в речовину D з константою швидкості k2
Швидкості обох паралельних реакцій визначається за рівняннями:
V1 = k1CA і V2 = k2CА.
Загальна швидкість паралельної реакції визначається загальною кількістю речовини А, що прореагувала, отже дорівнює сумі швидкостей двох реакцій:
![]() .
(13.1)
.
(13.1)
Більш швидку реакцію називають головною, а повільнішу – побічною. Якщо швидкості реакцій приблизно однакові, то головною реакцією вважають ту, що призводить до утворення необхідного нам продукту. Відношення кількості одержаних продуктів дорівнює відношенню констант швидкості реакцій, тобто:
![]() .
(13.2)
.
(13.2)
Послідовниминазивають реакції, що складаються з декілька стадій, які йдуть одна за одною, тобто з утворенням проміжних продуктів.
Розглянемо найпростіший тип послідовної реакції, що складається з двох простих реакцій І-го порядку:
k1 k2
А Р С. (13.3)
Загальна швидкість послідовних реакцій визначається швидкістю найбільш повільної стадії. До послідовних реакцій відносять процеси дисоціації основ та слабких кислот, реакції омилення жирів, гідролізу солей і т.д.
Гідроліз вуглеводів-олігосахаридів також є послідовною реакцією:
+Н2О +Н2О
С18Н32О16 С6Н12О6 + С12Н22О11 3С6Н12О6.
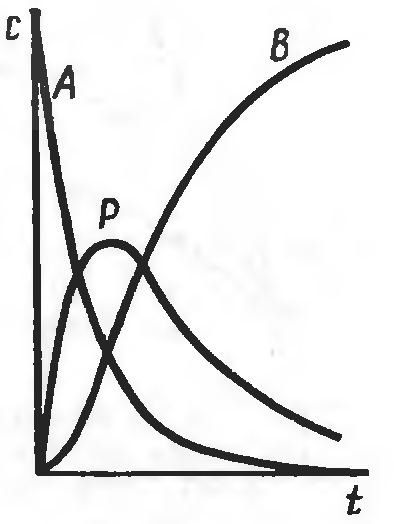
На рис. 13.1 наведено характер зміни концентрацій реагенту – А, проміжного продукту – Р і продукту реакції – В під час перебігу послідовної реакції (13.3).
Рисунок 13.1 – Зміна концентрації реагентів і продуктів реакції під час перебігу послідовної реакції
13.2 Ланцюгові хімічні реакції
Ланцюговими називають реакції, що перебігають за участю активних часточок – радикалів, і складаються з великої кількості стадій, які безперервно повторюються. Прикладом ланцюгової реакції є процес синтезу НCl з простих речовин. Під час освітлення суміші водню і хлору квант світлової енергії перетворює молекулу Cl2 на два радикали – активні атоми, які мають неспарені електрони. Ця реакція є процесом зародження ланцюгу:
Cl2 + hv Cl + Cl.
Радикал Хлору взаємодіє з молекулою водню, утворюючи молекулу НCl і радикал Гідрогену. Останній, у свою чергу, взаємодіє з молекулою Cl2, при цьому в реакційному середовищі знову з’являється радикал Хлору:
Cl + Н2 НCl + Н;
Н + Cl2 НCl + Cl.
Радикал Хлору, що утворився, реагує з молекулою Н2 і процес повторюється. В результаті спостерігається безперервний ланцюг однакових перетворень, який може сягати мільйони реакцій.
Одночасно в середовищі можуть перебігати процеси обриву ланцюгу, наприклад: Cl + Cl ⇄ Cl2 або Н + Н ⇄ Н2 або Н + Cl ⇄ НCl.
Якщо на стадії зародження ланцюгу утворюється більше, ніж одна активна часточка, то така ланцюгова реакція називається розгалуженою. Швидкість розгалужених реакцій зростає подібно лавині, і за достатньо великої кількості реагентів їх перебіг завершується вибухом.
