
- •«Тюменский государственный нефтегазовый университет»
- •Физика, часть 3
- •1.Волновая оптика
- •1.1.Световой вектор. Уравнение плоской световой волны
- •1.2. Интерференция световых волн. Условия, необходимые для осуществления интерференции
- •1.3.Условия максимумов и минимумов при интерференции световых волн
- •1.4.Интерференция в тонких пленках
- •1.5. Кольца Ньютона
- •Контрольные вопросы
- •Дифракция света. Принцип Гюйгенса-Френеля
- •Дифракция от одной щели.
- •Дифракция на одномерной дифракционной решётке
- •Угловая дисперсия и разрешающая способность дифракционной решетки
- •Угловая дисперсия равна:
- •Дифракция рентгеновских лучей на пространственной решетке
- •Поглощение света
- •Поляризация света. Естественный и поляризованный свет
- •Поляризация при отражении и преломлении
- •Двойное лучепpеломление. Поляpизационные пpизмы и поляpоиды. Явление дихpоизма
- •Вpащение плоскости поляpизации. Искуственная оптическая анизотpопия. Эффект Кеppа и его пpименение
- •1.Явления квантовой оптики
- •1.1. Тепловое излучение и его характеристики. Закон Кирхгофа
- •1.2.Законы излучения абсолютно черного тела. Законы Стефана-Больцмана и Вина
- •1.3.Формула Релея-Джинса. Ультрафиолетовая катастрофа. Квантовая гипотеза и формула Планка
- •1.4.Оптическая пирометрия
- •1.5.Квантовая природа света. Фотон и его характеристики.
- •1.6. Виды фотоэффекта. Внешний фотоэффект и его законы.
- •1.7. Эффект Комптона
- •1.8. Коpпускуляpно-волновой дуализм свойств света
- •1.9. Контрольные вопросы и задачи к разделу «Явления квантовой оптики»
- •2.Элементы квантовой механики
- •2.1. Гипотеза де Бройля. Корпускулярно-волновой дуализм микрочастиц
- •Опыты Девиссона и Джермера (1927г.)
- •Опыты Тартаковского и Томсона (1928 г.)
- •2.2. Соотношение неопределенностей
- •Волновая функция
- •Уравнение Шредингера
- •2.5.Задача квантовой механики о движении свободной частицы
- •Задача квантовой механики о частице в одномерной прямоугольной потенциальной яме
- •Понятие о туннельном эффекте
- •1. Автоэлектронная (холодная) эмиссия электронов
- •1.8. Атом водорода в квантовой механике. Квантовые числа
- •Здесь и совпадает с формулой радиуса первой боровской орбиты; численное значение этого параметра равно;a – множитель, который можно определить из условия нормировки волновой функции:
- •2.10. Спин электрона. Принцип Паули
- •2.11. Спектр атома водорода
- •2.12. Распpеделение электpонов в атоме по энеpгетическим состояниям. Пеpиодическая система элементов д.И.Менделеева
- •2.13. Рентгеновское излучение
- •2.14. Поглощение света, спонтанное и вынужденное излучения
- •2.15. Лазеры
- •1. Инверсия населенностей
- •2. 16. Способы создания инверсии населенностей
- •2.17. Положительная обратная связь. Резонатор
- •2.18. Принципиальная схема лазера
- •2.17. Линейный гаpмонический осциллятоp
- •3.6. Понятие о квантовой теории электропроводности металлов
- •3.7. Явление сверхпроводимости. Свойства сверхпроводников
- •Критические температуры перехода для некоторых сверхпроводников
- •4.Зонная теория твёрдых тел
- •4.1. Энергетические зоны электронов в кристалле
- •4.2. Металлы, полупроводники, диэлектрики в зонной теории твёрдых тел
- •4.3.Полупроводники. Собственная проводимость полупроводников
- •4.4. Примесная проводимость полупроводников
- •4.5. Равновесные концентрации носителей заряда в полупроводнике
- •4.6. Зависимость электропроводности полупроводников от температуры
- •Электронно-дырочный переход
- •Внутренний фотоэффект
- •Воздействие излучения на полупроводник. Фоторезистивный эффект
- •Устройство и характеристики фоторезисторов
- •Применение фоторезисторов
- •Фотоэффект в электронно-дырочном переходе. Фото-э.Д.С.
- •Применение вентильного фотоэффекта
- •Биполярный транзистор
- •Состав и характеристики атомного ядра
- •Характеристики атомного ядра
- •Ядерные силы
- •Понятие об обменном характере ядерных сил. Кванты ядерного поля
- •Радиоактивность
- •Ядерные реакции
- •Деление атомных ядер
- •Элементарные частицы
- •2 Кристаллические решетки твердых тел представляют собой периодические структуры и являются естественными трехмерными дифракционными решетками.
1.8. Атом водорода в квантовой механике. Квантовые числа
Атом – наименьшая частица вещества, обладающая всеми химическими свойствами элемента. Простейшим атомом является атом водорода, состоящий из одного протона и одного электрона.
Рассмотрим движение электрона в
кулоновском поле ядра с зарядом
![]() .
ПриZ=1
такая система соответствует атому
водорода, при иныхZ
– водородоподобному иону.
Водородоподобными ионами принято
называть ионы
.
ПриZ=1
такая система соответствует атому
водорода, при иныхZ
– водородоподобному иону.
Водородоподобными ионами принято
называть ионы![]() ,
имеющие ядро с зарядом
,
имеющие ядро с зарядом![]() и один электрон.
и один электрон.
Потенциальная энергия электрона зависит от его расстояния от ядра и определится формулой:
![]() . (2.69)
. (2.69)

Эта зависимость представлена графически на рис.2.13. Поэтому принято говорить, что электрон в водородоподобном атоме находится внутри гиперболической центрально-симметричной потенциальной ямы.
Запишем уравнение Шредингера для этого случая:
![]() . (2.70)
. (2.70)
Здесь
![]() -
оператор Лапласа. Так как потенциальная
яма имеет центрально- симметричную
форму, то оператор Лапласа необходимо
взять в сферической системе координат:
-
оператор Лапласа. Так как потенциальная
яма имеет центрально- симметричную
форму, то оператор Лапласа необходимо
взять в сферической системе координат:![]() ,
и волновые функции в общем случае будут
зависеть от координат
,
и волновые функции в общем случае будут
зависеть от координат![]() .
Данная задача успешно решена в квантовой
механике, но решение ее достаточно
громоздкое, и мы его здесь не приводим.
Рассмотрим лишь основные результаты,
которые следуют из решения уравнения
(2.70).
.
Данная задача успешно решена в квантовой
механике, но решение ее достаточно
громоздкое, и мы его здесь не приводим.
Рассмотрим лишь основные результаты,
которые следуют из решения уравнения
(2.70).
Уравнение (2.70) имеет решение в следующих случаях:
при любых положительных значениях энергии электрона E>0. Этот случай соответствует свободному электрону, не связанному с атомом;
при дискретных отрицательных значениях энергии:
![]() ,
(n=1, 2, 3….). (2.71)
,
(n=1, 2, 3….). (2.71)
Значения
![]() называютсобственными
значениями.
называютсобственными
значениями.
Собственные функции уравнения содержат 3целочисленных параметра. Их называютквантовыми числамии обозначаютn, l, m.
![]() . (2.72)
. (2.72)
Параметр nназываетсяглавнымквантовым числом. Оно определяетэнергию электрона в атомеи может принимать любые целочисленные значения.Энергия электрона в атоме квантуется.
Число lназываетсяорбитальнымквантовым числом. При данномnоно может принимать значения:l =0, 1, 2…. , n -1(всегоnзначений).
Орбитальное квантовое число lопределяет возможные значения момента импульса электронаL:
![]() . (2.73)
. (2.73)
Момент импульса электрона квантуется.
Различные значения орбитального квантового числа электрона служат для систематики электронных состояний в атомах и молекулах. Приняты следующие обозначения:
l=0 – s –состояние;
l =1 – p –состояние;
l =2 – d –состояние;
l =3 – f –состояние.
Значение главного квантового числа указывается перед условным обозначением квантового числа l. Возможны следующие состояния электрона:
1s,
2s, 2p,
3s, 3p, 3d,
4s, 4p, 4d, 4f и т.д.
Число mназываетсямагнитнымквантовым числом. При заданномlмагнитное квантовое число может принимать значения:
ml=0, 1, 2, ….,l, (всего 2l +1 значение).
Магнитное
квантовое число определяет возможные
значения проекции орбитального момента
импульса на направление внешнего
магнитного поля.
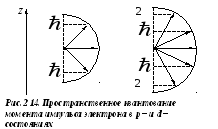
Это означает, что существует пространственное
квантование:
вектор момента импульса
![]() может иметь только вполне определенные
дискретные ориентации в пространстве.
Проекция момента импульса на направление
Z
может принимать значения
может иметь только вполне определенные
дискретные ориентации в пространстве.
Проекция момента импульса на направление
Z
может принимать значения
![]()
 (1.8.6)
(1.8.6)
На
рис.2.14 показано пространственное
квантование вектора
![]() для электронов вp–
и d–
состояниях.
для электронов вp–
и d–
состояниях.
Различные состояния атома с одинаковой энергией называются вырожденными, а число состояний с одинаковой энергией называется кратностью вырождения.
Число различных состояний соответствующих данному n и различным l и m можно рассчитать по формуле
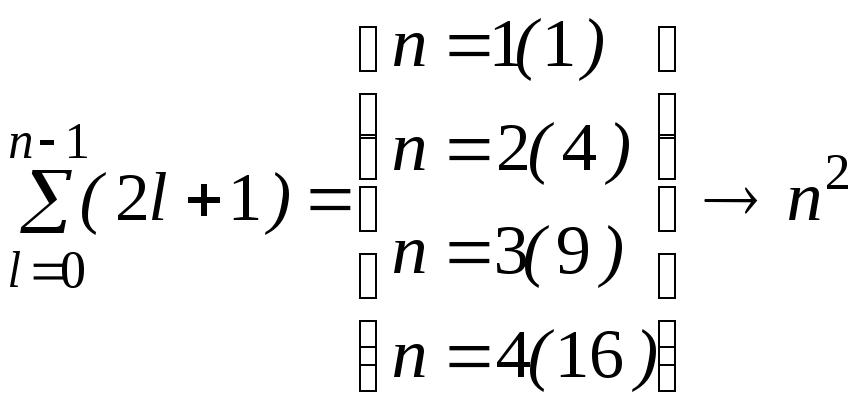 . (2.74)
. (2.74)
Таким образом, каждый уровень энергии атома водорода имеет вырождение кратности n2. В таблице 2.2 приведены состояния, соответствующие первым трем энергетическим уровням.
Таблица 2.2. Состояния электрона в атоме водорода
|
Уровень энергии
|
Волновая функция
|
Значение |
Число состояний | ||
|
n |
l |
m | |||
|
|
|
1 |
0 |
0 |
1 |
|
|
|
2 |
0 |
0 |
4 |
|
|
2 |
1 |
0 | ||
|
|
2 |
1 |
+1 | ||
|
|
2 |
1 |
-1 | ||
|
|
|
3 |
0 |
0 |
Всего 9 |
|
|
3 |
1 |
0 | ||
|
|
3 |
1 |
+1 | ||
|
|
3 |
1 |
-1 | ||
|
-------- |
------ |
------ |
------ | ||
2.9. 1s– состояние электрона в атоме водорода
Волновая функция электрона для 1s– состояния зависит только от расстоянияrэлектрона от ядра, т.е. является сферически симметричной. Ее выражение имеет вид
![]() . (2.75)
. (2.75)
