
- •«Тюменский государственный нефтегазовый университет»
- •Физика, часть 3
- •1.Волновая оптика
- •1.1.Световой вектор. Уравнение плоской световой волны
- •1.2. Интерференция световых волн. Условия, необходимые для осуществления интерференции
- •1.3.Условия максимумов и минимумов при интерференции световых волн
- •1.4.Интерференция в тонких пленках
- •1.5. Кольца Ньютона
- •Контрольные вопросы
- •Дифракция света. Принцип Гюйгенса-Френеля
- •Дифракция от одной щели.
- •Дифракция на одномерной дифракционной решётке
- •Угловая дисперсия и разрешающая способность дифракционной решетки
- •Угловая дисперсия равна:
- •Дифракция рентгеновских лучей на пространственной решетке
- •Поглощение света
- •Поляризация света. Естественный и поляризованный свет
- •Поляризация при отражении и преломлении
- •Двойное лучепpеломление. Поляpизационные пpизмы и поляpоиды. Явление дихpоизма
- •Вpащение плоскости поляpизации. Искуственная оптическая анизотpопия. Эффект Кеppа и его пpименение
- •1.Явления квантовой оптики
- •1.1. Тепловое излучение и его характеристики. Закон Кирхгофа
- •1.2.Законы излучения абсолютно черного тела. Законы Стефана-Больцмана и Вина
- •1.3.Формула Релея-Джинса. Ультрафиолетовая катастрофа. Квантовая гипотеза и формула Планка
- •1.4.Оптическая пирометрия
- •1.5.Квантовая природа света. Фотон и его характеристики.
- •1.6. Виды фотоэффекта. Внешний фотоэффект и его законы.
- •1.7. Эффект Комптона
- •1.8. Коpпускуляpно-волновой дуализм свойств света
- •1.9. Контрольные вопросы и задачи к разделу «Явления квантовой оптики»
- •2.Элементы квантовой механики
- •2.1. Гипотеза де Бройля. Корпускулярно-волновой дуализм микрочастиц
- •Опыты Девиссона и Джермера (1927г.)
- •Опыты Тартаковского и Томсона (1928 г.)
- •2.2. Соотношение неопределенностей
- •Волновая функция
- •Уравнение Шредингера
- •2.5.Задача квантовой механики о движении свободной частицы
- •Задача квантовой механики о частице в одномерной прямоугольной потенциальной яме
- •Понятие о туннельном эффекте
- •1. Автоэлектронная (холодная) эмиссия электронов
- •1.8. Атом водорода в квантовой механике. Квантовые числа
- •Здесь и совпадает с формулой радиуса первой боровской орбиты; численное значение этого параметра равно;a – множитель, который можно определить из условия нормировки волновой функции:
- •2.10. Спин электрона. Принцип Паули
- •2.11. Спектр атома водорода
- •2.12. Распpеделение электpонов в атоме по энеpгетическим состояниям. Пеpиодическая система элементов д.И.Менделеева
- •2.13. Рентгеновское излучение
- •2.14. Поглощение света, спонтанное и вынужденное излучения
- •2.15. Лазеры
- •1. Инверсия населенностей
- •2. 16. Способы создания инверсии населенностей
- •2.17. Положительная обратная связь. Резонатор
- •2.18. Принципиальная схема лазера
- •2.17. Линейный гаpмонический осциллятоp
- •3.6. Понятие о квантовой теории электропроводности металлов
- •3.7. Явление сверхпроводимости. Свойства сверхпроводников
- •Критические температуры перехода для некоторых сверхпроводников
- •4.Зонная теория твёрдых тел
- •4.1. Энергетические зоны электронов в кристалле
- •4.2. Металлы, полупроводники, диэлектрики в зонной теории твёрдых тел
- •4.3.Полупроводники. Собственная проводимость полупроводников
- •4.4. Примесная проводимость полупроводников
- •4.5. Равновесные концентрации носителей заряда в полупроводнике
- •4.6. Зависимость электропроводности полупроводников от температуры
- •Электронно-дырочный переход
- •Внутренний фотоэффект
- •Воздействие излучения на полупроводник. Фоторезистивный эффект
- •Устройство и характеристики фоторезисторов
- •Применение фоторезисторов
- •Фотоэффект в электронно-дырочном переходе. Фото-э.Д.С.
- •Применение вентильного фотоэффекта
- •Биполярный транзистор
- •Состав и характеристики атомного ядра
- •Характеристики атомного ядра
- •Ядерные силы
- •Понятие об обменном характере ядерных сил. Кванты ядерного поля
- •Радиоактивность
- •Ядерные реакции
- •Деление атомных ядер
- •Элементарные частицы
- •2 Кристаллические решетки твердых тел представляют собой периодические структуры и являются естественными трехмерными дифракционными решетками.
2.11. Спектр атома водорода
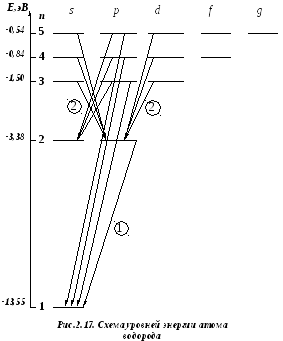
Изобразим схему уровней энергии атома водорода (рис.2.17).
Испускание и поглощение света происходит при переходе электрона с одного энергетического уровня на другой. В квантовой механике доказывается, что наиболее вероятны (возможны) только такие переходы, при которых изменение квантового числа lравно
![]() . (2.87)
. (2.87)
Это условие называется правилом отбора.
При переходе электронов излучается квант энергии, равный
![]() . (2.88)
. (2.88)
Здесь
![]() -
энергия уровня, соответствующего
значению главного квантового числаni,ν –
частота,λ– длина волны излучения. Формулу (2.88)
можно представить в виде:
-
энергия уровня, соответствующего
значению главного квантового числаni,ν –
частота,λ– длина волны излучения. Формулу (2.88)
можно представить в виде:
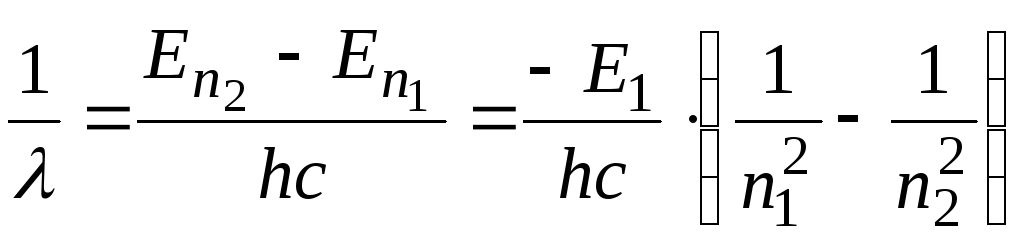 , (2.89)
, (2.89)
где
![]() .
.
Группа спектральных линий с одинаковыми
![]() называетсясерией. Назовем некоторые
серии линий спектра атомов водорода:
называетсясерией. Назовем некоторые
серии линий спектра атомов водорода:
![]() –серия
Лаймана,
она находится в ультрафиолетовой части
спектра.
–серия
Лаймана,
она находится в ультрафиолетовой части
спектра.
![]() –серия
Бальмера, она
находится в видимой части спектра.
–серия
Бальмера, она
находится в видимой части спектра.
![]() -
серия
Пашена,
она находится в инфракрасной части
спектра.
-
серия
Пашена,
она находится в инфракрасной части
спектра.
На рис.2.17 изображены электронные переходы, соответствующие сериям Лаймана (1) и Бальмера (2) с учетом правил отбора (2.87).
Формулу (2.89) можно записать в виде
![]() , (2.90),
, (2.90),
где
![]() . (2.91)
. (2.91)
Выражение
(2.90) называется сериальной
формулой.
Величина R
называется постоянной
Ридберга;
ранее она была установлена экспериментально,
ее численное значение равно
![]() ,
что совпадает с вычисленным по формуле
(2.90).
,
что совпадает с вычисленным по формуле
(2.90).
2.12. Распpеделение электpонов в атоме по энеpгетическим состояниям. Пеpиодическая система элементов д.И.Менделеева
В 1869 году Д.И.Менделеев открыл периодический закон, согласно которому химические и некоторые физические свойства элементов зависят от их масс. Основы теории пеpиодической системы элементов были разработаны гораздо позже с квантовых позиций.
Квантовая теория периодических изменений химических и физических свойств элементов построена на следующих предположениях.
Порядковый номер элемента Zравен общему числу электронов в атоме данного элемента.
Состояние электрона в атоме определяется набором четырех квантовых чисел: n , l , m,
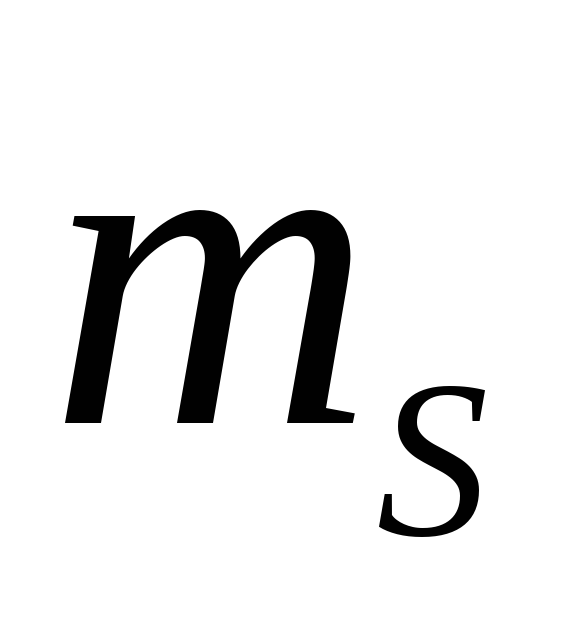 .
.Распределение электронов в атоме по энергетическим состояниям должно удовлетворять принципу минимума потенциальной энергии. При возрастании числа электронов в атоме каждый последующий электрон занимает только состояние с наименьшей энергией.
Заполнение энергетических состояний электронами в атоме должно подчиняться принципу Паули.
Из вышеизложенного следует: электроны в атоме могут занимать только определённые энергетические состояния. При этом химические и некоторые физические свойства элементов определяются валентными электронами атома.
Заполнение энергетических состояний подчиняется следующим принципам.
Все электроны в атомах, у которых одинаковы значения главного квантового числа n, образуютэлектронный слой. Максимальное число электронов в каждом слое определяется формулой:
![]() .
(2.92)
.
(2.92)
При n=1
![]() (K
- слой);
(K
- слой);
n=2
![]() (L
- слой);
(L
- слой);
n=3
![]() (M
- слой)
и так далее.
(M
- слой)
и так далее.
В каждом слое электроны распределяются по оболочкам, каждой оболочке соответствует определённое значение орбитального квантового числа l.
Максимальное число электронов в оболочке определяется формулой:
![]() ,
(2.93)
,
(2.93)
где число lможет принимать значения:l=0,1,2,…….n-1.
Некоторые значения![]() и
и
![]() представлены в таблице 2.3.
представлены в таблице 2.3.
Таблица 2.3
|
n |
Слой |
|
|
|
1 |
K |
2 |
2 |
|
2 |
L |
8 |
6 |
|
3 |
M |
18 |
10 |
Электронные состояния в атоме принято обозначать символами.Например, основное состояние атома кислорода выражается следующими символами:1S2, 2S2, 2P4. Это означает, что в 1S- и 2S-состояниях находятся по два электрона, в 2P4-состоянии находятся четыре электрона.
В реальной периодической системе элементов имеются отступления от порядка заполнения энергетических состояний, который приведён в таблице. Такой порядок заполнения энергетических состояний имеет место в том случае, когда электронов в атоме не слишком много. При увеличении числа электронов в атоме на их энергию, кроме взаимодействия электронов с ядром, оказывает существенное влияние взаимодействие электронов между собой. Поэтому, если электронов в атоме много, то может оказаться, что состояние с большим nи малымl может быть для электрона более выгодно, чем состояние с малымnи большимl .
В квантовой механике показывается, что среднее расстояние электрона от ядра является периодической функцией времени. При переходе электрона из состояния nв состояниеm(n→m)среднее расстояние электрона определится выражением:
![]() .
(2.94)
.
(2.94)
Здесь
![]() и
и![]() - волновые функции электрона в состоянииnиm.
- волновые функции электрона в состоянииnиm.
Интеграл (2.94) при определённых условиях может обращаться в нуль; это означает, что переход электрона из состояния n в состояние m запрещён, и спектральной линии в этом случае не будет.
В квантовой механике существуют правила
отбора,которые ограничивают число
возможных переходов электронов в атоме.Возможны лишь такие переходы, при
которых
![]() .
.
Волновые функции
![]() и
и![]() зависят от квантовых чисел: n,
l,
m,
mS
.Расчёт показывает, что для электрона,
движущегося в центрально-симметричном
поле ядра,
зависят от квантовых чисел: n,
l,
m,
mS
.Расчёт показывает, что для электрона,
движущегося в центрально-симметричном
поле ядра,
![]() при условии,что изменение орбитального
квантового числа
при условии,что изменение орбитального
квантового числа
![]() .
.
Примечание. Помимо правил отбора по орбитальному квантовому числу существуют и другие правила отбора, например, по магнитному квантовому числу. Их рассмотрение выходит за рамки данного пособия.
