
- •Биоорганическая химия
- •Теория строения органических соединений а.М.Бутлерова.
- •Классификация и номенклатура органических соединений.
- •Основные классы органических соединений
- •Образование и типы химических связей в органических соединениях.
- •Классификация органических реакций.
- •По характеру изменений связей в субстрате и реагенте.
- •Э электрофил лектрофильная реакция:
- •Н Нуклеофил уклеофильная реакция:
- •В соответствии с конечным результатом.
- •Электрофильное замещение se
- •Электрофильное присоединение аe
- •По числу частиц, принимающих участие в элементарной стадии.
- •Взаимное влияние атомов в молекулах органических соединений и способы его передачи.
- •Сопряжение.
- •Кислотность и основность органических соединений
- •Кислотность и основность по Бренстеду.
- •Кислоты и основания Льюиса.
- •Жесткие и мягкие кислоты и основания.
- •План описания органических соединений:
- •Алканы (предельные, насыщенные углеводороды, парафины)
- •Физические свойства.
- •Способы получения.
- •Промышленные
- •Лабораторные
- •Химические свойства.
- •Реакции галогенирования
- •Нитрование (реакция Коновалова)
- •3. Сульфирование и сульфохлорирование.
- •4. Окисление.
- •5. Изомеризация.
- •6. Дегидрирование.
- •7. Крекинг.
- •I. Промышленные.
- •Лабораторные.
- •Дегидратация спиртов:
- •Химические свойства.
- •Реакции присоединения.
- •3) Присоединение галогеноводородов (гидрогалогенирование):
- •4) Присоединение воды (гидратация):
- •2. Реакции окисления.
- •4) Озонолиз (окисление озоном):
- •3. Реакции полимеризации.
- •I. Промышленные.
- •II. Лабораторные.
- •Дегалогенирование тетрагалогенпроизводных:
- •Химические свойства.
- •Реакции электрофильного присоединения.
- •Присоединение галогенов (галогенирование):
- •Присоединение галогеноводородов:
- •Присоединение воды (реакция Кучерова):
- •Реакции нуклеофильного присоединения.
- •Реакции окисления-восстановления.
- •Реакции полимеризации.
- •Реакции замещения.
- •Алкадиены (диеновые углеводороды)
- •Способы получения.
- •Дегидратация двухатомных спиртов:
- •Химические свойства.
- •Электронное строение бутадиена-1,3.
- •Реакции присоединения.
- •Гидрирование:
- •Галогенирование:
- •Гидрогалогенирование:
- •Реакции полимеризации.
- •Галогенпроизводные алифатического ряда.
- •Физические свойства.
- •Способы получения.
- •Электронное строение и химические свойства.
- •Реакции нуклеофильного замещения.
- •Реакции элиминирования.
- •Ароматические углеводороды (арены)
- •Изомерия.
- •Способы получения.
- •Переработка угля и нефти:
- •Электронное строение бензола.
- •Химические свойства.
- •Реакции присоединения.
- •Реакции окисления.
- •Реакции замещения.
- •Галогенирование:
- •Сульфирование:
- •Алкилирование (реакция Фриделя-Крафтса):
- •Ацилирование:
- •Правила ориентации заместителей.
- •Спирты (алкоголи)
- •Физические свойства.
- •Способы получения.
- •Гидратация алкенов:
- •2. Гидролиз галогенпроизводных:
- •3. Спиртовое брожение сахаров:
- •Электронное строение и химические свойства.
- •1. Кислотные и основные свойства.
- •Реакции с участием нуклеофильного центра.
- •Образование простых эфиров (межмолекулярная дегидратация):
- •Образование сложных эфиров:
- •Реакции с участием электрофильного центра.
- •Реакции с участием сн-кислотного центра (реакции элиминирования).
- •5. Реакции окисления.
- •4. Восстановление:
- •Классификация.
- •Способы получения.
- •Химические свойства.
- •1. Кислотные и основные свойства.
- •2. Реакции с участием нуклеофильного центра.
- •3. Реакции с участием электрофильного центра.
- •4. Реакции электрофильного замещения в ароматическом ядре.
- •5. Реакции окисления-восстановления.
- •Карбонильные соединения (альдегиды и кетоны).
- •Бутаналь бутанон-2 Физические свойства.
- •Способы получения.
- •Электронное строение и химические свойства.
- •Реакции присоединения.
- •Гидратация:
- •Присоединение спиртов:
- •Присоединение тиолов:
- •2. Реакции конденсации.
- •3. Реакции окисления.
- •1. Окисление кислородом воздуха:
- •2. Окисление аммиачным раствором оксида серебра (реакция «серебряного зеркала»):
- •4. Реакции полимеризации.
- •Карбоновые кислоты.
- •Предельные одноосновные карбоновые кислоты. Номенклатура.
- •Способы получения.
- •Электронное строение и химические свойства.
- •Кислотные свойства.
- •Реакции нуклеофильного замещения.
- •Реакция этерификации:
- •Образование ангидридов:
- •Образование галогенангидридов:
- •Образование амидов:
- •Реакции по углеродному атому.
- •Реакции декарбоксилирования.
- •Функциональные производные карбоновых кислот
- •Галогенангидриды.
- •Ангидриды.
- •Сложные эфиры.
- •Тиоэфиры.
- •Классификация.
- •Номенклатура.
- •Способы получения.
- •Восстановление нитросоединений:
- •Аммонолиз и аминолиз галогенпроизводных:
- •Химические свойства.
- •Основные свойства.
- •Кислотные свойства.
- •3. Нуклеофильные свойства.
- •Ацилирование аминов:
- •4. Реакции с азотистой кислотой.
- •1 . Первичные алифатические амины
- •2. Первичные ароматические амины:
- •3. Вторичные алифатические и ароматические амины:
- •Электрофильное замещение в ароматических аминах.
4. Восстановление:
При каталитическом гидрировании тиолов происходит удаление атома серы из молекулы тиола и образуются соответствующие углеводороды:
Н2, Ni, 3000С
C2H5SH С2Н6 + Н2S
ФЕНОЛЫ
Фенолы – органические соединения, в которых один или несколько атомов водорода ароматического кольца замещены на гидроксильные группы.
Общая формула фенолов Ar–ОН (Ar – ароматический радикал).
Классификация.
По числу –ОН-групп в ароматическом кольце различают:
1. Одноатомные фенолы
- от толуола – крезолы от ксилола - ксиленолы
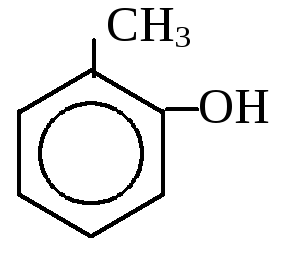
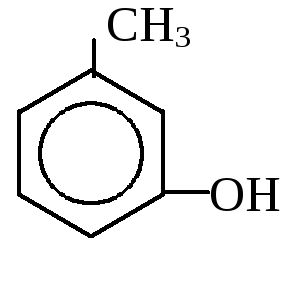
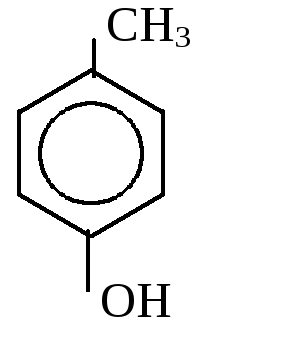
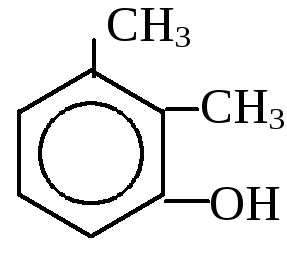
о-крезол м-крезол п-крезол
2. Двухатомные

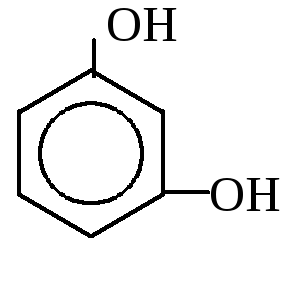
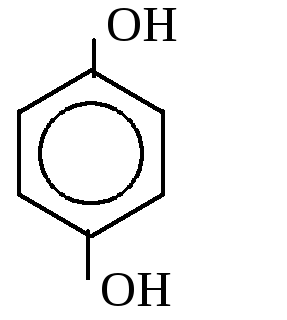
1,2-дигидроксибензол 1,3-дигидроксибензол 1,4-дигидроксибензол
(пирокатехин) (резорцин) (гидрохинон)
3. Трехатомные
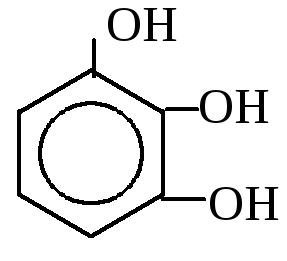


пирогаллол флороглюцин гидроксигидрохинон
Способы получения.
1. Выделение из каменноугольной смолы.
2. Щелочное плавление солей ароматических сульфокислот:

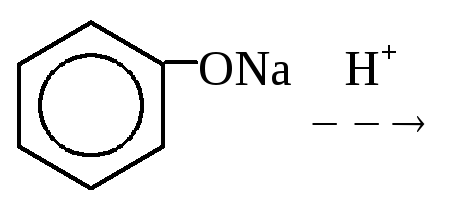
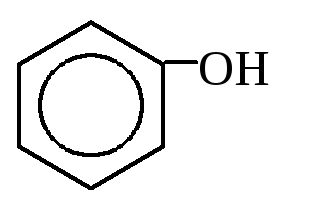
3. Гидролиз галогенбензолов:
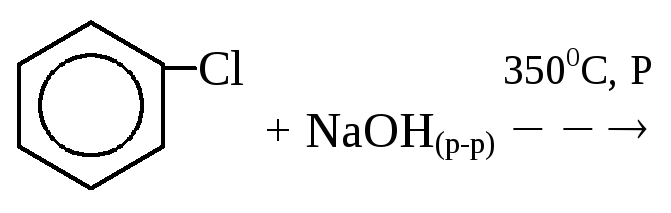
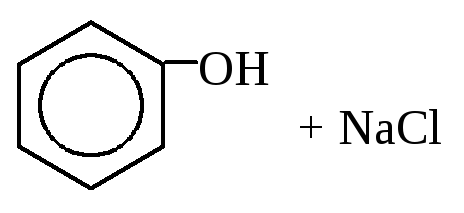
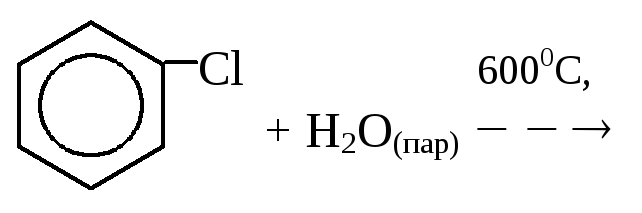

4. Кумольный синтез фенола (реакция Сергеева):
AlCl3 +O2 СН3 +Н+
С6Н6 + СН2=СНСН3 С6Н5СН(СН3)2 С6Н5СООН С6Н5ОН + СН3ССН3
Кумол СН3
Химические свойства.
Реакционными центрами в молекулах фенолов являются фенольная гидроксильная группа и ароматическое кольцо, взаимно влияющие друг на друга. Фенольная гидроксильная группа за счет р,сопряжения с кольцом является электронодонором.
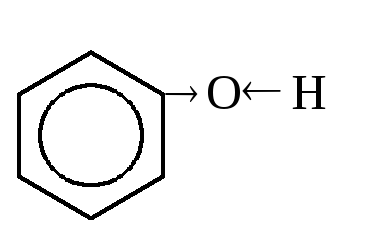
Сопряжение группы ОН с ароматическим кольцом обусловливает дефицит электронной плотности на атоме кислорода, в результате чего протон гидроксильной группы фенолов становится более подвижным, чем в спиртах, т.е. увеличиваются кислотные свойства. В то же время основные и нуклеофильные свойства фенольного гидроксила понижены по сравнению со спиртовым.
Благодаря электронодонорному влиянию фенольного гидроксила электронная плотность ароматического кольца повышена по сравнению с бензолом, особенно в орто- и пара-положениях. Это существенно облегчает протекание реакций электрофильного замещения и окисления.
1. Кислотные и основные свойства.
Повышенная кислотность фенолов проявляется в их способности взаимодействовать с растворами щелочей:
С6Н5ОН + NaОН С6Н5ОNa + Н2О
феноксид натрия
Однако фенол не реагирует с гидрокарбонатом натрия, т.к. он слабее угольной кислоты. Напротив, действием СО2 на феноксиды получают свободный фенол:
С6Н5ОNa + СО2 + Н2О С6Н5ОН + NaНСО3
Заместители в ароматическом кольце влияют на кислотность фенолов. Электронодонорные заместители снижают кислотность, а элнектроноакцепторные сильно увеличивают кислотность. Например, по своим кислотным свойствам 2,4,6-тринитрофенол (пикриновая кислота) приближается к сильным минеральным кислотам.
Вследствие р,сопряжения гидроксильной групы с ароматическим кольцом фенолы являются очень слабыми основаниями Бренстеда. Поэтому фенолы не образуют солей даже с сильными минеральными кислотами.
