
- •Биоорганическая химия
- •Теория строения органических соединений а.М.Бутлерова.
- •Классификация и номенклатура органических соединений.
- •Основные классы органических соединений
- •Образование и типы химических связей в органических соединениях.
- •Классификация органических реакций.
- •По характеру изменений связей в субстрате и реагенте.
- •Э электрофил лектрофильная реакция:
- •Н Нуклеофил уклеофильная реакция:
- •В соответствии с конечным результатом.
- •Электрофильное замещение se
- •Электрофильное присоединение аe
- •По числу частиц, принимающих участие в элементарной стадии.
- •Взаимное влияние атомов в молекулах органических соединений и способы его передачи.
- •Сопряжение.
- •Кислотность и основность органических соединений
- •Кислотность и основность по Бренстеду.
- •Кислоты и основания Льюиса.
- •Жесткие и мягкие кислоты и основания.
- •План описания органических соединений:
- •Алканы (предельные, насыщенные углеводороды, парафины)
- •Физические свойства.
- •Способы получения.
- •Промышленные
- •Лабораторные
- •Химические свойства.
- •Реакции галогенирования
- •Нитрование (реакция Коновалова)
- •3. Сульфирование и сульфохлорирование.
- •4. Окисление.
- •5. Изомеризация.
- •6. Дегидрирование.
- •7. Крекинг.
- •I. Промышленные.
- •Лабораторные.
- •Дегидратация спиртов:
- •Химические свойства.
- •Реакции присоединения.
- •3) Присоединение галогеноводородов (гидрогалогенирование):
- •4) Присоединение воды (гидратация):
- •2. Реакции окисления.
- •4) Озонолиз (окисление озоном):
- •3. Реакции полимеризации.
- •I. Промышленные.
- •II. Лабораторные.
- •Дегалогенирование тетрагалогенпроизводных:
- •Химические свойства.
- •Реакции электрофильного присоединения.
- •Присоединение галогенов (галогенирование):
- •Присоединение галогеноводородов:
- •Присоединение воды (реакция Кучерова):
- •Реакции нуклеофильного присоединения.
- •Реакции окисления-восстановления.
- •Реакции полимеризации.
- •Реакции замещения.
- •Алкадиены (диеновые углеводороды)
- •Способы получения.
- •Дегидратация двухатомных спиртов:
- •Химические свойства.
- •Электронное строение бутадиена-1,3.
- •Реакции присоединения.
- •Гидрирование:
- •Галогенирование:
- •Гидрогалогенирование:
- •Реакции полимеризации.
- •Галогенпроизводные алифатического ряда.
- •Физические свойства.
- •Способы получения.
- •Электронное строение и химические свойства.
- •Реакции нуклеофильного замещения.
- •Реакции элиминирования.
- •Ароматические углеводороды (арены)
- •Изомерия.
- •Способы получения.
- •Переработка угля и нефти:
- •Электронное строение бензола.
- •Химические свойства.
- •Реакции присоединения.
- •Реакции окисления.
- •Реакции замещения.
- •Галогенирование:
- •Сульфирование:
- •Алкилирование (реакция Фриделя-Крафтса):
- •Ацилирование:
- •Правила ориентации заместителей.
- •Спирты (алкоголи)
- •Физические свойства.
- •Способы получения.
- •Гидратация алкенов:
- •2. Гидролиз галогенпроизводных:
- •3. Спиртовое брожение сахаров:
- •Электронное строение и химические свойства.
- •1. Кислотные и основные свойства.
- •Реакции с участием нуклеофильного центра.
- •Образование простых эфиров (межмолекулярная дегидратация):
- •Образование сложных эфиров:
- •Реакции с участием электрофильного центра.
- •Реакции с участием сн-кислотного центра (реакции элиминирования).
- •5. Реакции окисления.
- •4. Восстановление:
- •Классификация.
- •Способы получения.
- •Химические свойства.
- •1. Кислотные и основные свойства.
- •2. Реакции с участием нуклеофильного центра.
- •3. Реакции с участием электрофильного центра.
- •4. Реакции электрофильного замещения в ароматическом ядре.
- •5. Реакции окисления-восстановления.
- •Карбонильные соединения (альдегиды и кетоны).
- •Бутаналь бутанон-2 Физические свойства.
- •Способы получения.
- •Электронное строение и химические свойства.
- •Реакции присоединения.
- •Гидратация:
- •Присоединение спиртов:
- •Присоединение тиолов:
- •2. Реакции конденсации.
- •3. Реакции окисления.
- •1. Окисление кислородом воздуха:
- •2. Окисление аммиачным раствором оксида серебра (реакция «серебряного зеркала»):
- •4. Реакции полимеризации.
- •Карбоновые кислоты.
- •Предельные одноосновные карбоновые кислоты. Номенклатура.
- •Способы получения.
- •Электронное строение и химические свойства.
- •Кислотные свойства.
- •Реакции нуклеофильного замещения.
- •Реакция этерификации:
- •Образование ангидридов:
- •Образование галогенангидридов:
- •Образование амидов:
- •Реакции по углеродному атому.
- •Реакции декарбоксилирования.
- •Функциональные производные карбоновых кислот
- •Галогенангидриды.
- •Ангидриды.
- •Сложные эфиры.
- •Тиоэфиры.
- •Классификация.
- •Номенклатура.
- •Способы получения.
- •Восстановление нитросоединений:
- •Аммонолиз и аминолиз галогенпроизводных:
- •Химические свойства.
- •Основные свойства.
- •Кислотные свойства.
- •3. Нуклеофильные свойства.
- •Ацилирование аминов:
- •4. Реакции с азотистой кислотой.
- •1 . Первичные алифатические амины
- •2. Первичные ароматические амины:
- •3. Вторичные алифатические и ароматические амины:
- •Электрофильное замещение в ароматических аминах.
-
Основные свойства.
Амины, как и NH3, проявляют основные свойства, что обусловлено наличием неподеленной пары электронов на атоме азота. При взаимодействии с кислотами амины превращаются в аммониевые соли:
СН3NH2 +НСl СН3NH3+ Cl хлорид метиламмония
Соли аминов гидролитически устойчивы, хорошо растворимы в воде, легко кристаллизуются из водных растворов. Многие лекарственные вещества, относящиеся к классу аминов, применяются в виде солей с минеральными или органическими кислотами.
Алифатические амины – сильные основания. Водные растворы аминов имеют щелочную среду по лакмусу:
СН3 СН3
С
 Н3N
+ Н2О
СН3N+Н
ОН
Н3N
+ Н2О
СН3N+Н
ОН
СH3 СH3
Основность ароматических аминов существенно ниже, чем у аминов алифатических. Это объясняется тем, что неподеленная пара электронов атома азота вступает в р,сопряжение с электронами бензольного кольца:
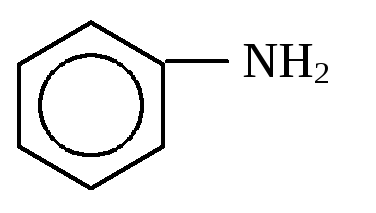
Заместители в кольце влияют на основность аминов: электронодонорные заместители ее увеличивают, а электроноакцепторные снижают.
-
Кислотные свойства.
NH-кислотные свойства аминов выражены в значительно меньшей степени, чем основные. Амины проявляют кислотные свойства только в присутствии очень сильных оснований и превращаются при этом в амиды металлов:
2СН3NH2 + 2Na 2СН3NHNa + Н2
метиламид натрия
(СН3)2NH + С4Н9Li (СН3)2NLi + C4H10
бутиллитий диметиламид лития
Амиды щелочных металлов являются очень сильными основаниями и используются в органическом синтезе.
3. Нуклеофильные свойства.
Нуклеофильные свойства аминов, как и основные обусловлены наличием неподеленной пары электронов атома азота.
-
Алкилирование аминов. (см. в получении)
-
Ацилирование аминов:
O
СН3NH2 + СН3СОCl СН3NHCCH3 + HCl
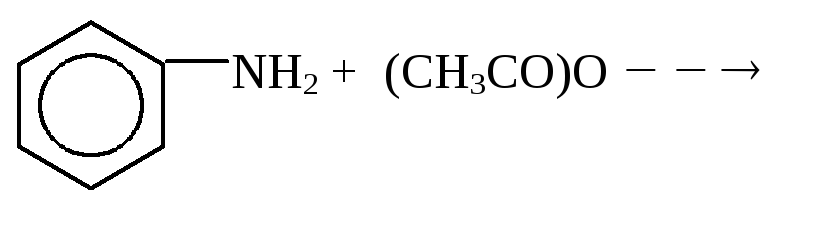
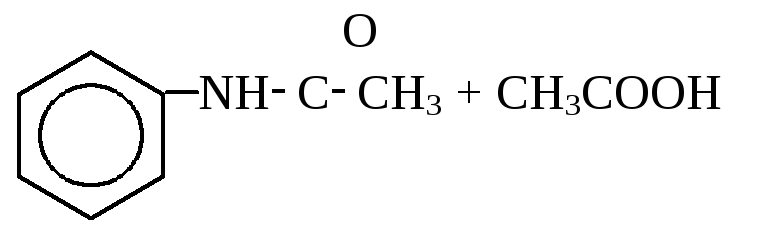
N-фенилацетамид
4. Реакции с азотистой кислотой.
Амины разных типов с азотистой кислотой реагируют неодинаково.
1 . Первичные алифатические амины
Эти амины при действии НNO2 в водных растворах подвергаются дезаминированию:
СН3СН2NH2 + НNO2 СН3СН2OH + N2 + H2O
2. Первичные ароматические амины:
При взаимодействии первичных ароматических аминов с НNO2 при низких температурах в присутствии сильных минеральных кислот образуются соли арилдиазония, а сама реакция называется реакцией диазотирования:
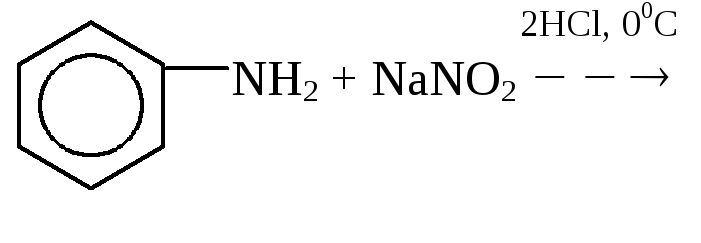
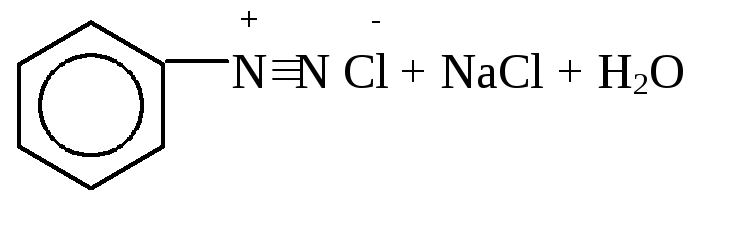
бензолдиазонийхлорид
Реакция имеет сложный механизм. В сильнокислой среде нитрозирующей частицей является нитрозил-катион, который взаимодействует со свободным амином. Образование нитрозил-катиона:
NaNO2 + HCl HNO2 + NaCl
H
 ON=O
+ HCl
HON=O
+ Cl
N=O
+ H2O
ON=O
+ HCl
HON=O
+ Cl
N=O
+ H2O
H
H H
ArNH2 + N=O ArNN=O ArNN=O ArN=NOH
H+
H
H+ + +
ArN=NOH ArNN + H2O
H
Ароматические соли диазония – неустойчивые соединения.
