
- •1. Броуновское движение
- •2. Законы идеального газа
- •3. Барометрическая формула.
- •4. Основное уравнение молекулярно-кинетической
- •5. Распределение Максвелла
- •6. Средняя длина свободного пробега
- •Vмол30 1030 м3, м.
- •7. Явления переноса
- •Диффузия в газах
- •8. Внутреннее трение
- •Теплопроводность
- •9. Первое начало термодинамики
- •10. Классическая теория теплоемкости
- •11. Адиабатический процесс
- •12. Политропический процесс
- •13. Энтропия. Второе и третье начала термодинамики
- •14. Расчет изменения энтропии в процессах
- •15. Цикл Карно. Второе начало термодинамики
- •16. Реальные газы. Критическое состояние
- •17. Уравнение Ван-дер-Ваальса
- •18. Особенности жидкого состояния вещества
- •19. Свободная энергия как функция состояния
- •Поверхностное натяжение
- •20. Условия равновесия на границах различных сред
- •21. Формула Лапласа
- •22. Фаза. Фазовое равновесие. Общая характеристика фазовых переходов 1-го и 2-го рода
- •23. Уравнение Клапейрона Клаузиуса.
- •24. Эффект Джоуля-Томсона
- •25. Методы получения низких температур
- •26. Термодинамическая шкала температур.
- •27. Симметрия кристаллов. Дефекты в кристаллах
- •Классическая теория теплоемкости твердых тел
- •28. Понятие о квантовой статистике. Распределения
- •29. Понятие о квантовой теории теплоемкости.
- •Рекомендуемая литература*
М.А. Жужа
Н.Г. Черная
Молекулярная
физика
Тексты лекций
Краснодар 2005
Предисловие
Настоящее учебное издание предназначено для студентов младших курсов вузов, изучающих раздел "Молекулярная физика" в рамках программы общего курса физики. Цель, которую преследовали авторы, – помочь студентам освоить основы молекулярной физики. Предлагаемое издание может оказать ощутимую помощь тем, у кого отсутствует опыт конспектирования лекций по физике, и в дальнейшем способствовать его приобретению.
При работе с текстами лекций необходимы знания по механике и математическому анализу. Изученный материал является основой для дальнейшего углубленного изучения термодинамики и статистической физики.
В лекциях отсутствуют сложные математические расчеты, при необходимости они могут быть вынесены на семинарские занятия или изучаться самостоятельно. Структура издания отвечает последовательности изложения материала в соответствии с программой курса.
Данное учебное издание следует считать необходимым, но не достаточным для глубокого понимания молекулярной физики и других разделов общего курса. Приступая к изучению молекулярной физики, необходимо ознакомиться с содержанием текстов лекций и рекомендованных в библиографии учебников. Следует внимательно изучать рисунки и самостоятельно воспроизводить формулы. Все, что в данном учебном издании выделено курсивом, жирным курсивом или обведено рамкой, является основным содержанием данной дисциплины (термины, законы, формулы...). Поэтому это следует знать наизусть.
ВВЕДЕНИЕ
Задачей молекулярной физики является изучение строения и физических свойств вещества в зависимости от характера движения и взаимодействия между частицами, составляющими вещество, с целью объяснения и прогнозирования его свойств.
Молекулярная физика основывается на молекулярно-кинетической теории строения вещества. Согласно этой теории: 1) все тела состоят из мельчайших частиц – атомов и молекул; 2) эти частицы находятся в непрерывном хаотическом движении, интенсивность которого зависит от температуры (поэтому его называют тепловым движением); 3) молекулы различных веществ по-разному взаимодействуют между собой.
Молекулярно-кинетическая теория подтверждается экспериментально броуновским движением, опытом Штерна, диффузией и другими явлениями (смешиванием жидкостей, растворением твердых тел и т.п.).
Наиболее известные агрегатные состояния вещества: 1) газообразное; 2) жидкое; 3) твердое. В современной физике объектами изучения являются и менее распространенные состояния, исследование которых находится в области интересов узких специалистов. Потребовалось много времени и усилий, чтобы доказать, что специфическими состояниями являются: вакуум; плазма; "жидкий свет" или конденсат Бозе-Эйнштейна. Для понимания свойств вещества, находящегося в этих состояниях, требуется знание дополнительных глав физики твердого тела, квантовой механики и статистики, термодинамики и пр., поэтому в курсе общей физики ограничиваются изучением первых трёх агрегатных форм. В дальнейшем будем опираться на их известные признаки:
-
газ не сохраняет ни формы, ни объема, заполняет все предоставленное ему пространство;
-
вещество в твердом состоянии сохраняет как форму, так и объем; атомы в твердых телах колеблются около равновесных положений в узлах кристаллической решетки;
-
жидкость сохраняет объем, но не сохраняет формы; жидкость принимает такую форму, которая соответствует действующим на нее силам (например, в невесомости – шар).
Тепловое движение частиц вещества в различных агрегатных состояниях не одинаково. Оно зависит от сил притяжения (на больших расстояниях) и отталкивания (на малых расстояниях) между молекулами. По своей природе эти силы электромагнитного происхождения.
Если суммарная кинетическая энергия атомов (молекул) во много раз больше их суммарной потенциальной энергии взаимного притяжения (ЕК >> ЕР), то вещество находится в газообразном состоянии; если во много раз меньше (ЕК << ЕР), то в твердом. Жидкое состояние образуется при примерном равенстве этих энергий (ЕК ЕР).
Физические модели, применяемые в механике (материальная точка, абсолютно твердое тело), переходят в молекулярной физике на микроуровень. Моделью материального тела в молекулярной физике является совокупность атомов и молекул, свойства и законы взаимодействия которых известны.
Модель идеального газа – наиболее простая. Это газ, состоящий из материальных точек с конечной массой, между которыми отсутствуют силы, действующие на расстоянии, которые хаотически (но поступательно) движутся и сталкиваются между собой по законам абсолютно упругих соударений. Изучив законы идеального газа по его модели, легко прийти к пониманию основного уравнения реального газа, внеся соответствующие поправки.
Моделью идеальной жидкости считают "трубку тока" единицы объема при нормальных условиях.
Существуют различные методы описания физических систем.
Динамический метод – основан на законах динамики (механики) Ньютона, например, зная законы соударения, положения и скорости всех частиц в некоторый момент времени, можно вычислить их положения и скорости во все последующие моменты времени. Однако, такой метод непригоден для большого числа частиц. Например, в 1 см3 воздуха при нормальных условиях содержится 2,681019 молекул (число Лошмидта). Следовательно, необходимо решить около 1020 уравнений движения (по три уравнения на каждую молекулу – для x, y, z). Если каждую секунду только записывать по одному уравнению, то затраты времени в 300 раз превысят возраст Вселенной, который оценивается в 1010 лет. Кроме того, молекулы непрерывно сталкиваются между собой, их координаты и скорости изменяются миллиарды раз в секунду.
Статистический метод – изучает статистические закономерности поведения большого числа частиц. Он основан на теории вероятности. Свойства тел, наблюдаемые на опыте (давление газа, температура …), истолковываются как суммарный, усредненный результат действия отдельных молекул. У отдельной молекулы нет температуры, она не производит давления. Температура и давление – это характеристики газа "в целом". Кроме того, температура не обладает свойством аддитивности, т.е. нельзя сказать, что температура тела в целом складывается из температур его частей. Этот раздел физики называется "статистическая физика".
Термодинамический метод – не рассматривает внутреннее строение вещества, не оперирует понятиями молекулярно-кинетической теории, а изучает различные превращения энергии, происходящие в системе. Этот раздел физики называется "термодинамика". Термодинамика основана на 3 законах (началах), установленных в результате обобщения опытных данных.
Статистический и термодинамический методы дополняют друг друга.
Следует напомнить три важнейших понятия молекулярной физики.
Моль – количество вещества, в котором содержится столько же структурных элементов (молекул, атомов, ионов…), сколько содержится атомов в углероде-12 (12С) массой 0,012 кг.
Молярная масса – это масса 1 моля. Например, для воды:
М(Н2О) = 0,018 кг/моль.
В одном моле содержится число Авогадро частиц:
NА = 6,0221023 моль1.
1. Броуновское движение
Броуновское движение – наблюдаемое под микроскопом непрерывное хаотическое движение мелких частиц, взвешенных в газе или жидкости. Оно является одним из наиболее убедительных доказательств реальности движения молекул. Это явление было открыто в 1827 г. английским ботаником Броуном при изучении взвешенных в воде мельчайших спор. Броуновское движение не было связано с биологическим происхождением частиц. Подобные движения совершают любые малые частицы, взвешенные в жидкости или газе (например, частицы дыма в неподвижном воздухе).
Броуновское движение легко объясняется ударами молекул жидкости или газа по частице. Если частица велика, то число ударов, нанесенных с разных сторон, хорошо усредняется и частица неподвижна. Иное дело, когда частицы имеют размеры 0,1–1 мкм. Для таких малых размеров неизбежны отклонения от среднего и импульсы, сообщаемые частице ударяющимися о нее с разных сторон молекулами, оказываются нескомпенсированными. Такие случайные отклонения от средних значений физических величин, которые происходят в малом объеме или в течение малого промежутка времени, называются флуктуациями. Броуновское движение обусловлено флуктуациями давления, которое оказывают молекулы газа или жидкости на взвешенные частицы.
Количественная теория броуновского движения была впервые разработана Эйнштейном и, независимо от него, Смолуховским в 1905 г.
Б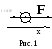 роуновская
частица находится под воздействием
двух основных сил (рис. 1). Это сила F –
равнодействующая сил нескомпенсированных
ударов молекул. Вторая сила – это сила
сопротивления среды FСОПР,
вызванная внутренним трением (вязкостью)
жидкости или газа. Если частица имеет
форму шара радиуса r, то применима формула
Стокса:
роуновская
частица находится под воздействием
двух основных сил (рис. 1). Это сила F –
равнодействующая сил нескомпенсированных
ударов молекул. Вторая сила – это сила
сопротивления среды FСОПР,
вызванная внутренним трением (вязкостью)
жидкости или газа. Если частица имеет
форму шара радиуса r, то применима формула
Стокса:
FСОПР = 6 r υ, (1)
где – коэффициент внутреннего трения (вязкости),
υ – скорость движения частицы.
В этом случае уравнение движения броуновской частицы (второй закон Ньютона) имеет вид
![]() или
в проекции на ось х:
или
в проекции на ось х:
![]() (точка
над "х"
– это производная по времени).
(точка
над "х"
– это производная по времени).
Надо найти закон движения х = f(t). Однако среднее значение смещения х за достаточно большой промежуток времени равно нулю, так как с равной вероятностью смещение частицы может иметь как положительный, так и отрицательный знак из-за хаотичности движения (и ударов) молекул. Поэтому надо искать другую величину, которая нулю не равняется. Такой величиной будет среднее значение квадрата смещения x2. После математических вычислений можно получить формулу Эйнштейна:
![]() ,
,
![]() ,
(2)
,
(2)
где D – коэффициент диффузии броуновской частицы; t – время наблюдения за частицей; k – постоянная Больцмана; Т – температура. В теории броуновского движения величина r, в общем случае, является эффективным размером частицы, определяемым экспериментально (например, если частица не шарообразной формы).
Таким образом, интенсивность движения броуновской частицы прямо пропорциональна температуре и обратно пропорциональна размеру частицы и вязкости среды.
2. Законы идеального газа
Состояние некоторой массы газа определяется заданием трех термодинамических параметров – давления р, объема V, и температуры Т. Связь между этими параметрами в общем виде можно выразить формулой F(p, V, T) = 0. Такое соотношение называется уравнением состояния системы (газа).
Простейшими свойствами обладает идеальный газ, т.е. газ, взаимодействием между молекулами которого можно пренебречь. Всякий достаточно разряженный газ близок к идеальному. Воздух, азот, кислород при обычных условиях (1 атм, комнатные температуры) мало отличаются от идеального газа.
Уравнение
состояния идеального газа
может быть записано в виде уравнения
Клапейрона:![]() .
(3)
.
(3)
Закон Авогадро: одинаковое количество молей любого газа при одинаковых температуре и давлении занимают одинаковые объемы.
В частности, при нормальных условиях (Т0 = 273,15 K, р0 = 1 атм = = 760 мм рт.ст. = 101325 Па) объем одного моля равен VМ = 22,4 л.
Отсюда следует, что, если любого газа взять 1 моль, то величина константы в уравнении Клапейрона (3) будет одинакова для всех газов. Обозначим ее буквой R и назовем универсальной газовой постоянной:
![]() .
.
Перепишем последнее уравнение в виде: pVM = RT.
Умножим его на произвольное число молей : pVM = RT.
Учтем,
что VM
= V
и
= m/M
(где m
– масса газа, а М
– молярная масса), и получим уравнение
Клапейрона-Менделеева
(уравнение состояния для произвольной
массы газа):
Умножим
и разделим правую часть уравнения
Клапейрона-Менделеева (4) на число
Авогадро NА:
Произведение
NA
дает нам общее число молекул N,
а отношение
R/NA
является постоянной Больцмана k.
Таким образом, имеем:
![]() .
(4)
.
(4)
![]() .
.
![]() или
или
![]() ,
(5)
,
(5)
где n – концентрация частиц.
Изопроцессами называются термодинамические процессы, происходящие в системе при каком-либо одном постоянном параметре состояния.
Пусть р0 и V0 – это давление и объем газа при 0 С.
Изотермический процесс (Т = const):
pV = const (закон Бойля-Мариотта).
Изохорический процесс (V = const): p/T = const. Другая форма записи: p = p0 (1 + t) , где = 1/273,15 K1 – термический коэффициент давления. Если в последнее уравнение вместо температуры по шкале Цельсия t подставить температуру по шкале Кельвина t = T 273,15, то после преобразований получим p = p0 T.
Изобарический
процесс
(p
= const):
![]() (закон Гей-Люссака). Другая форма записи:
V
= V0
(1 + t),
где
= 1/273,15 K1
– коэффициент объемного расширения.
Если в последнее уравнение вместо
температуры по шкале Цельсия t
подставить температуру по шкале Кельвина
t
= T
273,15,
то после преобразований получим V
= V0
T.
(закон Гей-Люссака). Другая форма записи:
V
= V0
(1 + t),
где
= 1/273,15 K1
– коэффициент объемного расширения.
Если в последнее уравнение вместо
температуры по шкале Цельсия t
подставить температуру по шкале Кельвина
t
= T
273,15,
то после преобразований получим V
= V0
T.
Г рафики
изопроцессов представлены на рис. 2.
рафики
изопроцессов представлены на рис. 2.
Предположим, что в сосуде находится в тепловом равновесии смесь газов, химически не реагирующих между собой. Пусть N – общее число молекул в сосуде, а N1, N2, … – количества молекул компонент смеси. Найдем давление этой смеси:
![]()
![]()
=
n1kT
+ n2kT
+ … =
![]() ,
(6)
,
(6)
где p1, р2 … – парциальные давления компонент смеси. Формула (6) показывает, что каждая группа молекул оказывает давление, не зависящее от других молекул. Можно сформулировать закон Дальтона: давление смеси газов равно сумме парциальных давлений ее компонент.
Найдем молярную массу смеси. Масса смеси равна mС = m1 + m2 +… Число частиц в смеси равно NC = N1 + N2 + … Найдем число частиц N как произведение числа Авогадро на число молей N = NA:
![]()
Отсюда
находим молярную
массу смеси:
![]() .
(7)
.
(7)
