
- •1. Броуновское движение
- •2. Законы идеального газа
- •3. Барометрическая формула.
- •4. Основное уравнение молекулярно-кинетической
- •5. Распределение Максвелла
- •6. Средняя длина свободного пробега
- •Vмол30 1030 м3, м.
- •7. Явления переноса
- •Диффузия в газах
- •8. Внутреннее трение
- •Теплопроводность
- •9. Первое начало термодинамики
- •10. Классическая теория теплоемкости
- •11. Адиабатический процесс
- •12. Политропический процесс
- •13. Энтропия. Второе и третье начала термодинамики
- •14. Расчет изменения энтропии в процессах
- •15. Цикл Карно. Второе начало термодинамики
- •16. Реальные газы. Критическое состояние
- •17. Уравнение Ван-дер-Ваальса
- •18. Особенности жидкого состояния вещества
- •19. Свободная энергия как функция состояния
- •Поверхностное натяжение
- •20. Условия равновесия на границах различных сред
- •21. Формула Лапласа
- •22. Фаза. Фазовое равновесие. Общая характеристика фазовых переходов 1-го и 2-го рода
- •23. Уравнение Клапейрона Клаузиуса.
- •24. Эффект Джоуля-Томсона
- •25. Методы получения низких температур
- •26. Термодинамическая шкала температур.
- •27. Симметрия кристаллов. Дефекты в кристаллах
- •Классическая теория теплоемкости твердых тел
- •28. Понятие о квантовой статистике. Распределения
- •29. Понятие о квантовой теории теплоемкости.
- •Рекомендуемая литература*
9. Первое начало термодинамики
Внутренняя энергия термодинамической системы U включает кинетическую энергию всех внутренних движений частиц (поступательных, вращательных, колебательных) и потенциальную энергию их взаимодействия. Для идеального газа мы пренебрегаем потенциальной энергией. Поэтому внутренняя энергия идеального газа определяется кинетической энергией его молекул, а кинетическая энергия для данной массы газа зависит только от температуры.
Внутренняя энергия является функцией состояния, т.е. определяется только состоянием системы (в данном случае – температурой) и не зависит от вида перехода в это состояние.
Если
система совершает круговой процесс
(цикл), возвращаясь в начальное состояние,
то полное изменение ее внутренней
энергии равно нулю:
![]() .
Как известно, математически это
соотношение означает, что элементарное
изменение dU
является полным (точным) дифференциалом.
.
Как известно, математически это
соотношение означает, что элементарное
изменение dU
является полным (точным) дифференциалом.
Изменить внутреннюю энергию системы можно двумя способами: 1) совершить над ней механическую работу; 2) сообщить системе количество теплоты. (Напомним, что 1 кал = 4,19 Дж.)
Первое начало термодинамики: количество теплоты, сообщенное системе, идет на приращение её внутренней энергии и на совершение системой работы над внешними телами:
Q = U + A или Q = dU + A. (40)
Входящие в формулу (40) величины могут быть, как положительными, так и отрицательными. Если количество теплоты передается системе, она нагревается и сама совершает работу над внешними телами, то величины – положительны. Если количество теплоты отбирается от системы, она остывает, и внешние силы совершают над ней работу, то величины – отрицательны.
Если система, например рабочее тело, в периодически действующем двигателе совершает круговой процесс (цикл), т.е. возвращается в исходное состояние, то U = 0 и при этом A = Q. Отсюда следует вторая формулировка первого начала термодинамики: невозможен вечный двигатель 1-го рода, т.е. такое периодически действующее устройство, которое бы совершало работу в большем количестве, чем полученная им извне энергия.
Н айдем
работу, которую совершает газ при
расширении. Пусть газ, действуя на
поршень с силой F
= pS,
перемещает его на расстояние dx
(рис. 22) и совершает элементарную работу
A
= F
dx
= pS
dx
= p
dV.
айдем
работу, которую совершает газ при
расширении. Пусть газ, действуя на
поршень с силой F
= pS,
перемещает его на расстояние dx
(рис. 22) и совершает элементарную работу
A
= F
dx
= pS
dx
= p
dV.
Полная работа находится интегрированием:
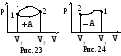
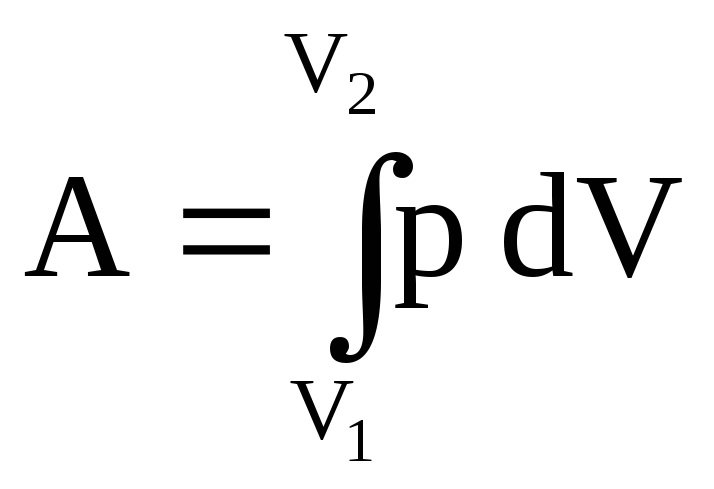 .
(41)
.
(41)
На графике в координатах (p, V) работа равна площади фигуры, ограниченной осью V, прямыми V1 и V2 и кривой p = f (V). Из рис. 23 видно, что работа (площадь под кривой) зависит от вида перехода системы из состояния 1 в состояние 2. Кроме того, работа в круговом процессе может быть не равна нулю. Поэтому работа А не является функцией состояния, а ее элементарное изменение не является полным дифференциалом. Для элементарной работы употребляют обозначения А или dA (а не дифференциал dA).
Если внешние силы уменьшают объем газа (рис. 24), то при интегрировании получается "отрицательная" работа, так как верхний предел интегрирования V2 меньше нижнего V1.
Применим первое начало термодинамики к изопроцессам.
И зохорический
процесс
V
= const
(рис.
25). Так как V
= const,
то dV
= 0
и А
= 0.
Из уравнения первого начала термодинамики
остается Q
= U.
В изохорическом процессе все количество
теплоты, подводимое к системе, полностью
идет на изменение ее внутренней энергии.
зохорический
процесс
V
= const
(рис.
25). Так как V
= const,
то dV
= 0
и А
= 0.
Из уравнения первого начала термодинамики
остается Q
= U.
В изохорическом процессе все количество
теплоты, подводимое к системе, полностью
идет на изменение ее внутренней энергии.
И зобарический
процесс
р
= const
(рис. 26). В этом процессе изменяется
внутренняя энергия и совершается работа
Q
= dU
+ pdV.
Работа в данном случае вычисляется
очень просто (это площадь прямоугольника):
зобарический
процесс
р
= const
(рис. 26). В этом процессе изменяется
внутренняя энергия и совершается работа
Q
= dU
+ pdV.
Работа в данном случае вычисляется
очень просто (это площадь прямоугольника):
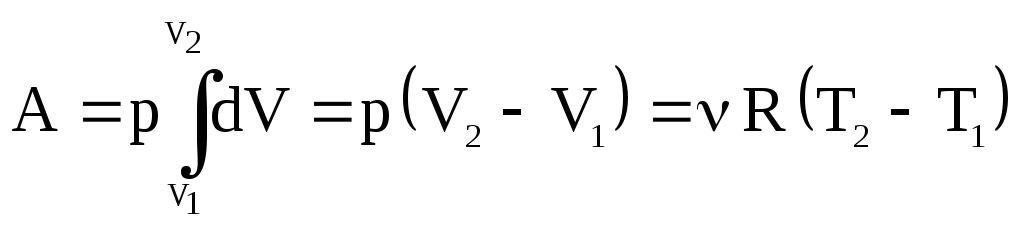 .
(42)
.
(42)
Выражение (42) определяет физический смысл газовой постоянной: если = 1 моль и Т2 – Т1 = 1 К, то А = R, т. е. R численно равна работе изобарного расширения 1 моля идеального газа при нагревании его на 1 К.
И зотермический
процесс
T
= const
(рис. 27). При этом процессе dU
= 0,
следовательно, Q
= A,
т.е. всё подводимое количество теплоты
тратится на совершение работы над
внешними телами. Для нахождения работы
выразим зависимость p
= f
(V)
из уравнения Клапейрона-Менделеева:
p
= RT/V.
Работа равна
зотермический
процесс
T
= const
(рис. 27). При этом процессе dU
= 0,
следовательно, Q
= A,
т.е. всё подводимое количество теплоты
тратится на совершение работы над
внешними телами. Для нахождения работы
выразим зависимость p
= f
(V)
из уравнения Клапейрона-Менделеева:
p
= RT/V.
Работа равна
![]() .
(43)
.
(43)
