
- •1. Броуновское движение
- •2. Законы идеального газа
- •3. Барометрическая формула.
- •4. Основное уравнение молекулярно-кинетической
- •5. Распределение Максвелла
- •6. Средняя длина свободного пробега
- •Vмол30 1030 м3, м.
- •7. Явления переноса
- •Диффузия в газах
- •8. Внутреннее трение
- •Теплопроводность
- •9. Первое начало термодинамики
- •10. Классическая теория теплоемкости
- •11. Адиабатический процесс
- •12. Политропический процесс
- •13. Энтропия. Второе и третье начала термодинамики
- •14. Расчет изменения энтропии в процессах
- •15. Цикл Карно. Второе начало термодинамики
- •16. Реальные газы. Критическое состояние
- •17. Уравнение Ван-дер-Ваальса
- •18. Особенности жидкого состояния вещества
- •19. Свободная энергия как функция состояния
- •Поверхностное натяжение
- •20. Условия равновесия на границах различных сред
- •21. Формула Лапласа
- •22. Фаза. Фазовое равновесие. Общая характеристика фазовых переходов 1-го и 2-го рода
- •23. Уравнение Клапейрона Клаузиуса.
- •24. Эффект Джоуля-Томсона
- •25. Методы получения низких температур
- •26. Термодинамическая шкала температур.
- •27. Симметрия кристаллов. Дефекты в кристаллах
- •Классическая теория теплоемкости твердых тел
- •28. Понятие о квантовой статистике. Распределения
- •29. Понятие о квантовой теории теплоемкости.
- •Рекомендуемая литература*
17. Уравнение Ван-дер-Ваальса
Из множества различных уравнений, предложенных для реального газа, наиболее простым и точным является уравнение Ван-дер-Ваальса (В-д-В). В модели реального газа В-д-В молекулы рассматриваются как абсолютно твердые шарики с эффективным диаметром d, между которыми действуют силы взаимного притяжения и отталкивания.
Уравнение В-д-В является приближенным, так как не существует точного способа вычисления сил взаимодействия между молекулами.
Уравнение В-д-В сводится к поправкам к уравнению идеального газа и для 1 моля имеет вид (уравнение состояния реальных газов)
где
a
и b
– постоянные
В-д-В, определяемые экспериментально
для каждого газа, VМ
– объем 1 моля.![]()
Поправка
![]() называется внутренним
давлением
и характеризует добавку к внешнему
давлению, обусловленную взаимным
притяжением
молекул. Из-за притяжения молекул газ
как бы сжимает сам себя и поэтому поправка
в формуле (80) приводится с "плюсом".
называется внутренним
давлением
и характеризует добавку к внешнему
давлению, обусловленную взаимным
притяжением
молекул. Из-за притяжения молекул газ
как бы сжимает сам себя и поэтому поправка
в формуле (80) приводится с "плюсом".
Поправка b = 4 NA VМОЛ равна учетверенному значению собственного объема всех молекул, где NA – число Авогадро (т.к. взят 1 моль газа), VМОЛ – объем одной молекулы. Если, например, в сосуде находятся две молекулы, то центр любой из них не может приблизиться к центру другой молекулы на расстояние, меньшее диаметра d молекулы (рис. 13). Это означает, что для центров обеих молекул оказывается недоступным для движения сферический объем радиуса d, т.е. объем, равный 8 объемам молекулы или учетверенному объему молекулы в расчете на одну молекулу. Поэтому в уравнении В-д-В вместо полного объема сосуда стоит "свободный" для движения объем, который получается вычитанием собственного объема молекул.
У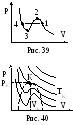 равнение
В-д-В – это уравнение третьей степени
относительно V.
Поэтому изотерма
В-д-В при температуре ниже критической
будет иметь вид, показанный на рис. 39.
Как видно, она отличается от изотермы
реального газа (пунктир). Однако при
некоторых условиях участки 1-2 и 3-4 могут
наблюдаться в эксперименте. Это так
называемые метастабильные
состояния
(очень неустойчивые). На участке 1-2 можно
получить пересыщенный
пар
(применяется в камере Вильсона). На
участке 3-4 реализуется перегретая
жидкость
(применяется в пузырьковой камере).
равнение
В-д-В – это уравнение третьей степени
относительно V.
Поэтому изотерма
В-д-В при температуре ниже критической
будет иметь вид, показанный на рис. 39.
Как видно, она отличается от изотермы
реального газа (пунктир). Однако при
некоторых условиях участки 1-2 и 3-4 могут
наблюдаться в эксперименте. Это так
называемые метастабильные
состояния
(очень неустойчивые). На участке 1-2 можно
получить пересыщенный
пар
(применяется в камере Вильсона). На
участке 3-4 реализуется перегретая
жидкость
(применяется в пузырьковой камере).
Семейство изотерм В-д-В показано на рис. 40. Постоянные В-д-В можно найти из критических параметров рК, ТК, VК. Как видно из рис. 40, критическая точка К является точкой перегиба изотермы, поскольку в ней совмещаются и минимумы, и максимумы. Следовательно, в критической точке и первая и вторая производные будут равны нулю. Если решить уравнение В-д-В относительно давления р:
![]() ,
,
а затем взять первую и вторую производные и приравнять их нулю, то можно получить связь постоянных В-д-В и критических параметров:
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
.
Чтобы написать уравнение В-д-В для произвольного числа молей , нужно учесть, что молей газа занимают в раз больший объем V = VM . Подставим в уравнение (80) выражение VM = V/, а затем умножим обе части равенства на . Получаем уравнение В-д-В для произвольного числа молей:
![]() ,
,
![]() .
(81)
.
(81)
При сильном разряжении газа В-д-В, когда взаимодействием между молекулами можно пренебречь, уравнение В-д-В переходит в уравнение Клапейрона-Менделеева.
Внутренняя
энергия газа В-д-В
должна включать, кроме кинетической
энергии молекул (которую мы раньше
определили для идеального газа) и энергию
взаимодействия между молекулами.
Воспользуемся тем, что работа, совершаемая
при расширении газа против сил взаимного
притяжения молекул, равна изменению
потенциальной энергии dA
= dEP.
Силы взаимного притяжения учтены в
уравнении В-д-В с помощью добавки к
давлению РВН
![]() .
Работа равна:
.
Работа равна:
![]() .
.
Внутренняя
энергия газа В-д-В равна сумме кинетической
и потенциальной энергий:
![]() .
.
Найдем
постоянную интегрирования. Если газ
расширяется, то силами взаимодействия
в разряженном газе можно пренебречь и
получается идеальный газ. Значит, при
стремлении объема газа к бесконечности
формула для внутренней энергии газа
В-д-В должна переходить в формулу для
внутренней энергии идеального газа.
Второе слагаемое в формуле внутренней
энергии газа В-д-В стремится к нулю при
стремлении объема к бесконечности.
Поэтому постоянную интегрирования
также следует положить равной нулю. В
итоге имеем формулу
для внутренней энергии газа В-д-В
![]() . (82)
. (82)
