
- •1. Броуновское движение
- •2. Законы идеального газа
- •3. Барометрическая формула.
- •4. Основное уравнение молекулярно-кинетической
- •5. Распределение Максвелла
- •6. Средняя длина свободного пробега
- •Vмол30 1030 м3, м.
- •7. Явления переноса
- •Диффузия в газах
- •8. Внутреннее трение
- •Теплопроводность
- •9. Первое начало термодинамики
- •10. Классическая теория теплоемкости
- •11. Адиабатический процесс
- •12. Политропический процесс
- •13. Энтропия. Второе и третье начала термодинамики
- •14. Расчет изменения энтропии в процессах
- •15. Цикл Карно. Второе начало термодинамики
- •16. Реальные газы. Критическое состояние
- •17. Уравнение Ван-дер-Ваальса
- •18. Особенности жидкого состояния вещества
- •19. Свободная энергия как функция состояния
- •Поверхностное натяжение
- •20. Условия равновесия на границах различных сред
- •21. Формула Лапласа
- •22. Фаза. Фазовое равновесие. Общая характеристика фазовых переходов 1-го и 2-го рода
- •23. Уравнение Клапейрона Клаузиуса.
- •24. Эффект Джоуля-Томсона
- •25. Методы получения низких температур
- •26. Термодинамическая шкала температур.
- •27. Симметрия кристаллов. Дефекты в кристаллах
- •Классическая теория теплоемкости твердых тел
- •28. Понятие о квантовой статистике. Распределения
- •29. Понятие о квантовой теории теплоемкости.
- •Рекомендуемая литература*
10. Классическая теория теплоемкости
идеального газа
Средняя
энергия 1 молекулы равна
![]() ,
,
где i – число степеней свободы молекулы.
Внутренняя
энергия 1 моля идеального газа, содержащего
число Авогадро молекул, равна
![]() .
.
Для
молей газа внутренняя энергия равна
![]() .
.
Теплоемкостью
тела
называется
количество теплоты, которое нужно
подвести к телу, чтобы повысить его
температуру на один градус
(например, теплоемкость калориметра):
СТЕЛА![]() [Дж/К].
(44)
[Дж/К].
(44)
Теплоемкость 1 моля называют молярной теплоемкостью С (или С) [Дж/(мольК)]. При этом Q = C (T2 – T1). (45)
Теплоемкость единицы массы вещества называют удельной теплоемкостью с [Дж/(кгК)]. При этом Q = c m (T2 – T1). (46)
Молярная и удельная теплоемкости связаны через молярную массу:
![]() (47)
(или C
v
= M
cv,
C
p
= M
cp,
где cV
и cP
см. далее).
(47)
(или C
v
= M
cv,
C
p
= M
cp,
где cV
и cP
см. далее).
Пусть
нагревание 1 моля идеального газа
происходит при V
= const.
Тогда из первого начала термодинамики
следует
![]() и
и
![]() ,
и молярная теплоемкость при постоянном
объеме равна
,
и молярная теплоемкость при постоянном
объеме равна
![]()
![]()
![]() .
(48)
.
(48)
Из
уравнения (48) также можно получить важное
соотношение:
![]() ,
а внутренняя энергия
молей равна
,
а внутренняя энергия
молей равна
![]() .
.
Пусть нагревание 1 моля идеального газа происходит при p = const. Тогда молярная теплоемкость при постоянном давлении равна
![]() .
.
Разделим уравнение (40) первого начала термодинамики на dT:
![]() ,
,
![]() ,
,
![]() .
.
Для нахождения производной dV/dT выразим объем из уравнения Клапейрона-Менделеева для 1 моля: V = RT/p. Таким образом,
![]() .
.
Мы
получили уравнение
Майера:
![]() . (49)
. (49)
Кроме того, выражение A/dT = R определяет физический смысл газовой постоянной R: газовая постоянная численно равна работе, которая совершается при расширении 1 моля идеального газа, нагретого на 1 градус при постоянном давлении [Дж/(моль К)].
Молярная
теплоемкость при постоянном давлении
может быть выражена из уравнения Майера
(49):
![]()
![]()
![]() .
(50)
.
(50)
Отношение
теплоемкостей
![]() (51)
(51)
представляет собой характеристическую для каждого газа величину (показатель адиабаты).
Для одноатомного газа (i = 3) = 1,67.
Для двухатомного газа (i = 5) = 1,4.
Для трехатомного газа (i = 6) = 1,33.
Полученные формулы для теплоемкости дают хорошее совпадение с экспериментом для одноатомных и многих двухатомных газов (H2, O2, N2) при комнатной температуре. Однако, существуют и различия эксперимента и теории, которые объясняются квантовой теорией теплоемкости.
11. Адиабатический процесс
Адиабатический процесс – это процесс, протекающий без теплообмена с внешней средой. Тогда из первого начала термодинамики следует:
dQ
= 0
dU + A
= 0
![]() . (52)
. (52)
Таким образом, при адиабатическом расширении газ совершает работу за счет убыли его внутренней энергии. Это обозначает, что его температура понижается (а если газ адиабатически сжимать, то он нагревается). Поэтому при адиабатическом процессе изменяются все три параметра – p, V, T. Следовательно, он не может называться изопроцессом.
Найдем уравнение адиабаты для произвольного числа молей . Для чего используем первое начало термодинамики:
A + dU = 0;
p dV + CV dT = 0. (53)
Исключим из уравнения (53) температуру, продифференцировав уравнение Клапейрона-Менделеева:
pV = RT p dV + V dp = R dT
![]() .
(54)
.
(54)
Подставим формулу (54) в уравнение (53), приведем выражение к общему знаменателю и учтем то, что дробь равна нулю, если ее числитель равен нулю (число молей при этом сокращается):
![]()
p CP dV – p CV dV + p CV dV + V CV dp = 0 (делим на pVCV),
![]() (интегрируем),
(интегрируем),
(постоянную интегрирования
возьмем в виде, удобном для дальнейших
расчетов)![]()
ln V + ln p = ln (const)
![]() .
(55)
.
(55)
Уравнение
(55) является уравнением
Пуассона
(адиабаты),
а величина
![]() > 1 является показателем
адиабаты.
> 1 является показателем
адиабаты.
Изобразим изотерму и адиабату на одном графике. Для этого продифференцируем их уравнения:
T
= const, pV = const,
p
dV + V dp = 0
![]() .
.
Q
= const, pV
= const,
![]()
![]() .
.
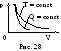
Следовательно, тангенс угла наклона (производная) адиабаты в раз больше, чем у изотермы: адиабата идет круче, поскольку при расширении газа давление уменьшается не только за счет увеличения объема, но и за счет уменьшения температуры самой системы (рис. 28).
Можно найти и другие формы записи уравнения адиабаты, подставив в уравнение (55) давление или объем, найденные из уравнения Клапейрона-Менделеева (pV = RT):
![]() (55)
(55)
![]() ,
,
![]() . (56)
. (56)
![]() (55)
(55)
![]() ,
,
![]() .
.
Возведем
последнее уравнение в степень (1/):
![]() . (57)
. (57)
Изотермический и адиабатический процессы являются идеализированными: изотермический требует идеального теплового контакта с окружающей средой, а адиабатический – идеальной теплоизоляции. Близкими к адиабатическому являются быстропротекающие процессы, когда теплообменом можно пренебречь.
Найдем работу при адиабатическом изменении объема газа. Пусть при этом р1 – начальное давление газа, а V1 – его начальный объем.
![]()
![]() .
.
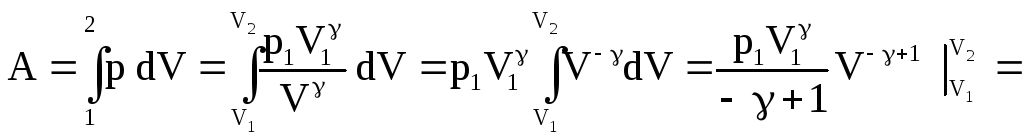
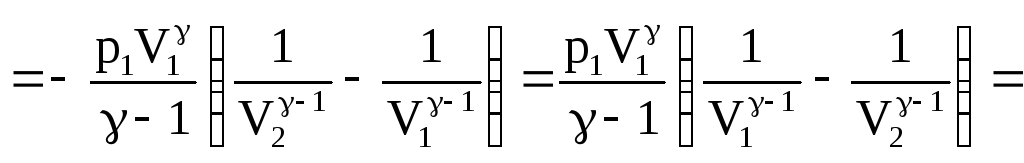
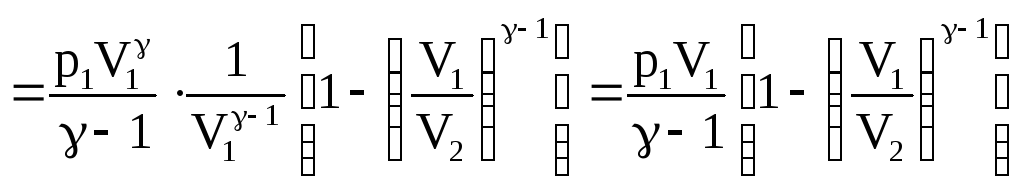 .
(58)
.
(58)
Если
по условию задачи даны температуры, то
в уравнении (58) можно произвести замены
p1V1
= (m/M)
RT1
и
![]() (последнее
следует из уравнения TV–1
= const).
В результате получим
(последнее
следует из уравнения TV–1
= const).
В результате получим
![]() .
(59)
.
(59)
Из уравнения (52) можно получить и другую формулу для работы молей газа:
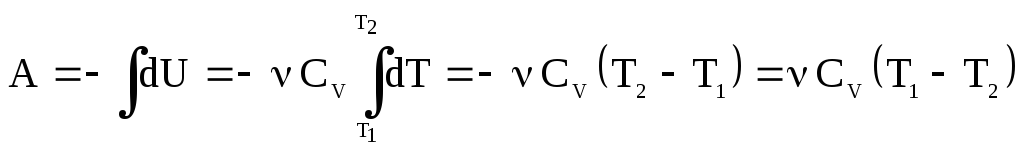 .
(60)
.
(60)
