
- •1. Броуновское движение
- •2. Законы идеального газа
- •3. Барометрическая формула.
- •4. Основное уравнение молекулярно-кинетической
- •5. Распределение Максвелла
- •6. Средняя длина свободного пробега
- •Vмол30 1030 м3, м.
- •7. Явления переноса
- •Диффузия в газах
- •8. Внутреннее трение
- •Теплопроводность
- •9. Первое начало термодинамики
- •10. Классическая теория теплоемкости
- •11. Адиабатический процесс
- •12. Политропический процесс
- •13. Энтропия. Второе и третье начала термодинамики
- •14. Расчет изменения энтропии в процессах
- •15. Цикл Карно. Второе начало термодинамики
- •16. Реальные газы. Критическое состояние
- •17. Уравнение Ван-дер-Ваальса
- •18. Особенности жидкого состояния вещества
- •19. Свободная энергия как функция состояния
- •Поверхностное натяжение
- •20. Условия равновесия на границах различных сред
- •21. Формула Лапласа
- •22. Фаза. Фазовое равновесие. Общая характеристика фазовых переходов 1-го и 2-го рода
- •23. Уравнение Клапейрона Клаузиуса.
- •24. Эффект Джоуля-Томсона
- •25. Методы получения низких температур
- •26. Термодинамическая шкала температур.
- •27. Симметрия кристаллов. Дефекты в кристаллах
- •Классическая теория теплоемкости твердых тел
- •28. Понятие о квантовой статистике. Распределения
- •29. Понятие о квантовой теории теплоемкости.
- •Рекомендуемая литература*
12. Политропический процесс
Политропическими называются процессы, при которых теплоемкость тела остается постоянной (C = const).
Изобарический, изохорический, изотермический и адиабатический процессы являются частными случаями политропического процесса.
В самом деле:
при
изохорическом процессе (V
= const)
![]() ;
;
при
изобарическом процессе (p
= const)
![]() ;
;
при
адиабатическом процессе
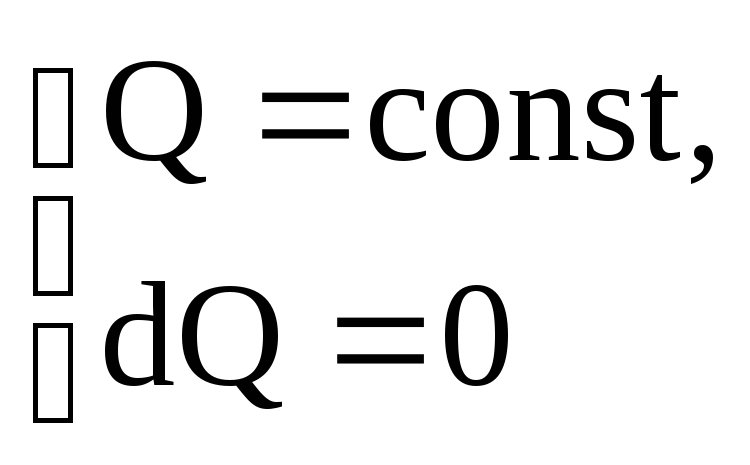
![]() ;
;
при
изотермическом процессе
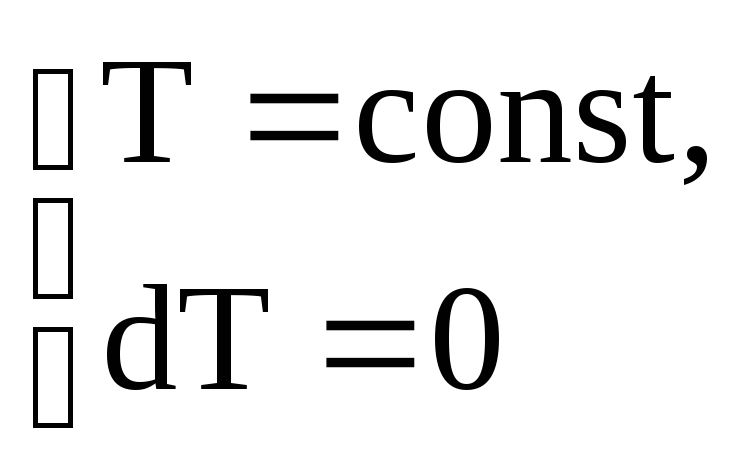
![]()
(при изотермическом процессе сообщение телу любого количества теплоты не приводит к изменению температуры тела).
Найдем
уравнение политропы. Для простоты
проведем расчет для 1 моля газа (если
проводить расчет для произвольного
числа молей, то число молей
при этом сокращается). Воспользуемся
определением теплоемкости:
![]() .
.
Из первого начала термодинамики следует:
dQ = dU + dA,
C dT = CV dT + p dV,
(C – CV) dT – p dV = 0. (61)
Аналогично тому, как это делалось при выводе уравнения адиабаты, исключим из уравнения (61) температуру:
pV = RT p dV + V dp = R dT
![]() .
(62)
.
(62)
Подставим формулу (62) в уравнение (61), приведем выражение к общему знаменателю и учтем то, что дробь равна нулю, если ее числитель равен нулю:
![]()
C p dV + CV dp – CV p dV – CV V dp – CP p dV + CV p dV = 0,
(C – CP) p dV + (C – CV) V dp = 0 [делим на (C – CV) pV],
![]() (63)
(63)
Введем показатель политропы как
![]() .
(64)
.
(64)
Продолжаем решать уравнение (63):
![]()
n ln V + ln p = ln (const),
![]() .
(65)
.
(65)
Уравнение (65) является уравнением политропы в координатах (p,V). Уравнение политропы в других координатах можно получить аналогично тому, как это делалось для уравнения адиабаты (или проще: индекс в уравнениях адиабаты можно заменить на n).
В рассмотренных уравнениях переменная С – это теплоемкость газа в конкретном процессе (в общем виде – политропическом).
Получим из общего уравнения (65) его частные случаи (процессы):
адиабатический
С = СА
= 0
(64)
![]()
(65)
(65)
pV = const;
изотермический
С = СТ
=
(64)
![]()
(65)
(65)
pV = const;
изобарический
С = СР
(64)
![]()
(65)
(65)
pV0 = p 1 = p = const;
изохорический
С = СV
(64)
![]() .
.
Из уравнения (65) извлечем корень n-й степени и получим
![]()
При подстановке в последнее уравнение величины n = имеем
p0V = 1V = V = const.
13. Энтропия. Второе и третье начала термодинамики
Система находится в термодинамическом равновесии, если макроскопические величины, определяющие ее состояние (p, V, T), остаются постоянными (нет процессов теплопроводности, диффузии, химических реакций, фазовых переходов и т.п.). Будучи выведенной из состояния равновесия внешними воздействиями система самопроизвольно возвращается к термодинамическому равновесию.
При обратимых процессах система возвращается в исходное состояние так, что как в самой системе, так и в окружающей среде не остается никаких изменений. Обратимым является процесс, для которого возможен обратный переход из конечного состояния в начальное через те же промежуточные состояния, что и в прямом процессе. Обратимыми являются все движения, рассматриваемые в механике, кроме тех, в которых участвуют диссипативные силы.
В молекулярной физике большинство процессов необратимо и имеет односторонний характер (переход тепла от горячего тела к холодному, распространение газа на весь объем, смешивание двух различных газов при диффузии).
Возьмем уравнение первого начала термодинамики:
Q = dU + A = CV dT + p dV. (66)
Найдем из уравнения Клапейрона-Менделеева давление p = RT/V и подставим его в уравнение (66):
![]() .
Разделим
обе части уравнения на Т:
.
Разделим
обе части уравнения на Т:
![]() .
(67)
.
(67)
Правая часть равенства (67) представляет собой полный дифференциал, следовательно, и левая часть также является полным дифференциалом.
Функция
состояния, полный дифференциал которой
равен
Q/T,
называется
энтропией
и обозначается буквой S:
![]() .
(68)
.
(68)
Свойства энтропии:
Энтропия замкнутой системы, совершающей обратимый цикл, не изменяется dSОБР = 0, или S = const.
В ходе необратимого процесса энтропия замкнутой системы возрастает dSНЕОБР > 0 и достигает максимального значения в равновесном состоянии (т.е. S2 > S1).
Второе начало термодинамики: энтропия замкнутой системы при любых происходящих в ней процессах не убывает dS 0. (Знак (>) соответствует необратимому процессу, а знак (=) обратимому.)
Если же система не замкнута, т.е. может обмениваться теплотой с окружающей средой, то энтропия может вести себя любым образом (увеличиваться, уменьшаться, не изменяться).
Энтропию можно также определить статистически с помощью формулы Больцмана: S = k ln , где k – постоянная Больцмана, – статистический вес или термодинамическая вероятность состояний.
– число различных равновероятных микросостояний (всевозможных распределений частиц по координатам и скоростям), которые реализуют данное термодинамическое макросостояние (p, V, T).
– число способов, реализуя которые система может прийти к данному равновесному состоянию.
В равновесном состоянии макропараметры (p, V, T) постоянны, однако микропараметры (скорости, координаты, импульсы частиц) постоянно меняются. Поэтому число очень огромно.
Состояние, которое осуществляется многими способами, называется беспорядочным или случайным. Следовательно, энтропия является мерой беспорядка в системе. Сообщение системе количества теплоты приводит к усилению хаотического движения молекул, увеличивает (энтропию) степень беспорядка в системе.
При абсолютном нуле Т = 0, движения нет, и все атомы тела закреплены в определенных местах. Существует только одно микросостояние = 1. Следовательно, энтропия равна нулю: S = k ln 1 = 0. Отсюда следует третье начало термодинамики (теорема Нернста): энтропия любого тела стремится к нулю при стремлении температуры к нулю или при Т = 0 в любом процессе S = 0.
Всякий естественный процесс всегда протекает так, что система переходит в состояние с более высокой степенью беспорядка, так как такое состояние характеризуется большей термодинамической вероятностью. С этим связана и необратимость тепловых процессов: беспорядок в системе увеличивается. Любой вид энергии (механической, электрической и т.п.) в конечном итоге переходит в тепловые (хаотические) колебания атомов и молекул.
Энтропия биологической системы "организм – внешняя среда" возрастает, а энтропия организма сохраняется (в небольшом интервале времени – биологическая стационарность). Упорядоченность организма сохраняется за счет уменьшения упорядоченности окружающей среды.
В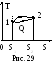 торое
начало термодинамики, установленное
для замкнутых систем на Земле не может
быть распространено на всю бесконечную
Вселенную. Иначе можно прийти к выводу,
что температуры всех тел во Вселенной
станут одинаковыми. При этом все формы
движения, кроме хаотического теплового,
должны прекратиться. Наступит "тепловая
смерть Вселенной".
торое
начало термодинамики, установленное
для замкнутых систем на Земле не может
быть распространено на всю бесконечную
Вселенную. Иначе можно прийти к выводу,
что температуры всех тел во Вселенной
станут одинаковыми. При этом все формы
движения, кроме хаотического теплового,
должны прекратиться. Наступит "тепловая
смерть Вселенной".
Из определения энтропии следует, что площадь под кривой на диаграмме (T, S) численно равна количеству теплоты Q12, полученному телом в ходе процесса 1 2 (рис. 29):
Q
= T dS,
![]() .
(69)
.
(69)
Для изотермического процесса Q12 = T (S2 – S1).
Как видно из рис. 29, количество теплоты (площадь под кривой) зависит от вида перехода 1 2. Следовательно, количество теплоты Q не является функцией состояния, а ее элементарное изменение Q не является полным дифференциалом.
