
- •Реферат
- •Введение
- •Обзор и анализ научно технической и патентной информации.
- •Нейтрофины.
- •Общая характеристика.
- •1.2 Нейротрофины в цнс
- •2. Рецепторы нейтрофинов.
- •2.1Высокоаффинный рецептор к нейротрофинам pl40 prototrk
- •2.2 Низкоаффинный рецептор к нейротрофинам p75lntr.
- •Фактор роста нервов.
- •История открытия
- •3.2 Молекулярная характеристика.
- •Третичная структура.
- •3.4 Механизм взаимодействия ngf с рецепторами.
- •3.5 Захват и ретроградный транспорт ngf.
- •3.6 Функции ngf в организме.
- •3.6.1 Действие ngf на нервные клетки.
- •3.6.2 Значение ngf в метаболизме.
- •3.6.3 Участие ngf в патологических состояниях.
- •4. Современные достижения в получении рекомбинантного ngf для фармацевтической индустрии.
- •5 Экспрессия рекомбинантных генов.
- •5.1 Вводная часть.
- •5.2 Конструирование экспрессионных векторов и их функционирование.
- •5.3 Факторы, оказывающие влияние на эффективность экспрессии рекомбинантных генов.
- •6 Выводы по разделу
- •Основная часть
- •1. Материалы, методы и оборудование
- •1.1 Оборудование
- •1.2 Программное обеспечение
- •1.3 Лабораторные посуда и расходные материалы.
- •1.4 Штаммы e.Coli
- •1.5 Среды для выращивания бактерий
- •1.6 Препараты днк
- •1.7 Ферменты
- •1.7 Реактивы и наборы реактивов
- •Приготовление рвs буфера (х10):
- •10% Уксусная кислота
- •1.9.1 Рестрикция
- •1.9.2 Электрофоретичское разделение днк в агарозном геле.
- •1.9.3 Выделение днк из агарозного геля.
- •1.9.4. Полимеразная цепная реакция (пцр).
- •1.9.5 Лигирование.
- •1.9.6 Pipes трансформация клеток e. Coli плазмидной днк
- •1.9.7 Культивирование, выделение и очистка плазмидной днк из клеток e. Coli
- •1.9.8 Проведение пцр-скрининга.
- •1.9.9 Секвенированиеплазмидной днк.
- •1.9.10 Быстрая трансформация.
- •1.9.11 Анализ экспрессии целевого гена.
- •1.9.12 Выделение суммарного (общего) белка из клеток e. Сoli.
- •1.9.14 Фракционирование белков из клеток e. Сoli.
- •1.9.15 Денатурирующий белковый электрофорез в sds-пааг.
- •1.9.16 Отмывка телец включения
- •1.9.17 Растворение телец включения
- •1.9.18 Выделение SumoNgf при помощи металло-хелат-аффинной хроматографии
- •1.9.19 Рефолдинг белка
- •1.9.20 Расщепление гибридного белка SumoNgf
- •2. Экспериментальные исследования
- •2.1 Получение векторных конструкций.
- •2.1.1 Сборка гена ngf методом пцр.
- •2.1.2 Получение векторной конструкции pTngf
- •2.1.3 Получение гибридной последовательности SumoNgf.
- •2.1.4 Получение векторной конструкции pTSumoNgf.
- •2.2 Биосинтез целевого и гибридного белка. Подбор условий культивирования.
- •2.2.1 Биосинтез белка ngf.
- •2.2.1 Биосинтез гибридного белка SumoNgf.
- •2.3 Выделение и очистка рекомбинантного фактора роста нервов человека.
- •2.3.1 Отмывка и растворение телец включения
- •2.3.2 Металло-хелатная аффинная хроматография
- •2.3.3 Масс-спектрометрия гибридного белка ngf
- •2.3.4 Рефолдинг гибридного белка SumoNgf
- •2.3.5 Ферментативное расщепление гибридного белка SumoNgf
- •2.3.5 Очистка ngf на катионобменной хроматографии.
- •2.3.5 Разработка обобщённой схемы производства рекомбинантного ngf
- •Организационно – экономический раздел
- •Технико-экономическое обоснование нир
- •2. Расчёт затрат на научно-исследовательскую работу
- •2.1. Расчет материальных затрат (Cм)
- •2.2. Энергетические затраты.
- •4.2.3. Расчет затрат на заработную плату.
- •2.4. Расчет затрат на стеклянную посуду, стеклянные приборы и пластик.
- •4.2.5. Амортизационные отчисления (Сам.).
- •2.6. Накладные расходы.
- •3 Выводы по разделу
- •Безопасность жизнедеятельности
- •1 Краткая характеристика выполняемой работы.
- •2 Опасные и вредные производственные факторы на основных стадиях выполнения дипломной работы.
- •3 Перечень наиболее опасных мест на стадиях выполнения дипломной работы.
- •Основные физико-химические, токсические и пожаровзрывоопасные свойства используемых в работе веществ.
- •5 Обеспечение безопасности труда в лаборатории.
- •6 Производственная санитария.
- •6.1 Установление категории лабораторного помещения.
- •6.2 Разработка мероприятий по работе с вредными веществами.
- •6.3 Метеорологические условия.
- •6.4 Вентиляция.
- •6.5 Освещение.
- •6.7 Отопление.
- •7 Техника безопасности.
- •7.1 Электробезопасность.
- •7.2 Пожарная профилактика.
- •8. Выводы по разделу.
2.3 Выделение и очистка рекомбинантного фактора роста нервов человека.
При экспрессии эукариотических генов в бактериальных клетках часть рекомбинантных эукариотических белков и некоторые прокариотические белки при высоком уровне биосинтеза переходят в нерастворимое состояние, образуя так называемые тельца включения.
Тельца включения представляют собой частицы, состоящие из агрегатов рекомбинантного белка и ряда бактериальных белков. Рекомбинантные белки в тельцах включения находятся в денатурированном неактивном состоянии, и для их получения в растворимом виде приходится применять мощные денатурирующие агенты, такие как мочевина, гуанидинхлорид и детергенты [].
2.3.1 Отмывка и растворение телец включения
Биомассу замороженных клеток подвергали ультразвуковой дезинтеграции в следующих лизис буферах: a) 50 мМ Tris pH 8.0 и 0.1 % Triton, б) 50 мМ Tris pH 8.0 и 100 мМ NaCI. Нерастворимую фракцию лизата клеток осаждали центрифугированием.
На следующем этапе осуществляли подбор условий растворения отмытых телец включения (Рисунок _ ).
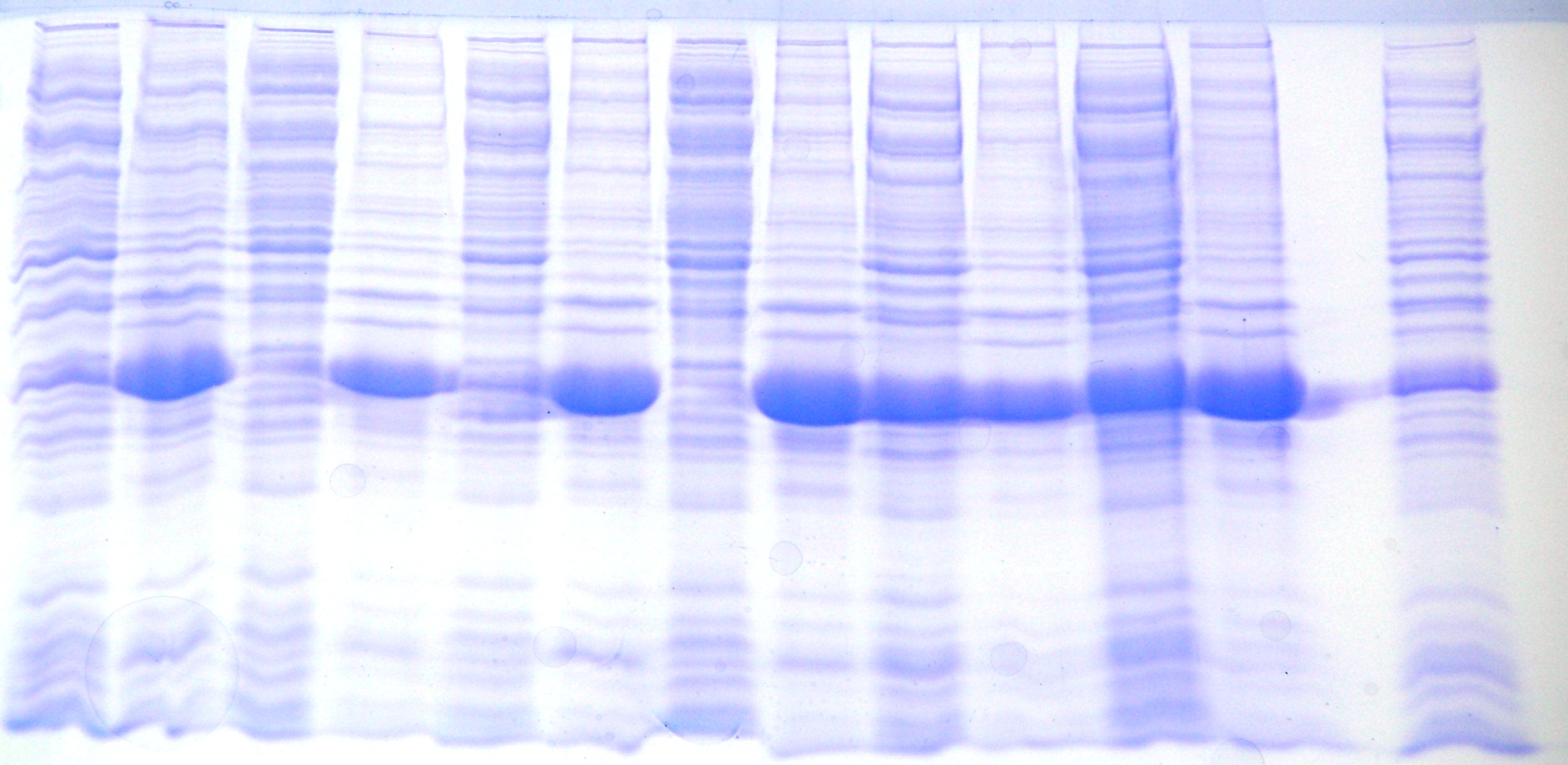
1 2 3 4 5 6 7 8 9 10 11 12
Рисунок _ - Подбор условий растворения отмытых телец включения.
1, 3, 5, 7, 9, 11 – супернатант; 2, 4, 6, 8, 10, 12 – осадок.
1, 2. Растворение буфером № 1, культивирование клеток при 25oC
3, 4. Растворение буфером № 1, культивирование клеток при 37oC
5, 6. Растворение буфером № 2, культивирование клеток при 25oC
7, 8. Растворение буфером № 2, культивирование клеток при 37oC
9, 10. Растворение буфером № 3, культивирование клеток при 25oC
11, 12. Растворение буфером № 3, культивирование клеток при 37oC
(Смотри метод 1.9.17 )
Как показывают результаты, частичный переход белка в растворенное состояние наблюдается только в буфере № 3, содержащем 5 M мочевину. Но этого не достаточно для дальнейших исследований и поэтому нами был рассмотрен метод растворения телец включения в буфере № 4 с 3.5 М гуанидингидрохлоридом [].
При использовании данного буфера происходит почти полное растворение телец включения (Рисунок _ ).
Р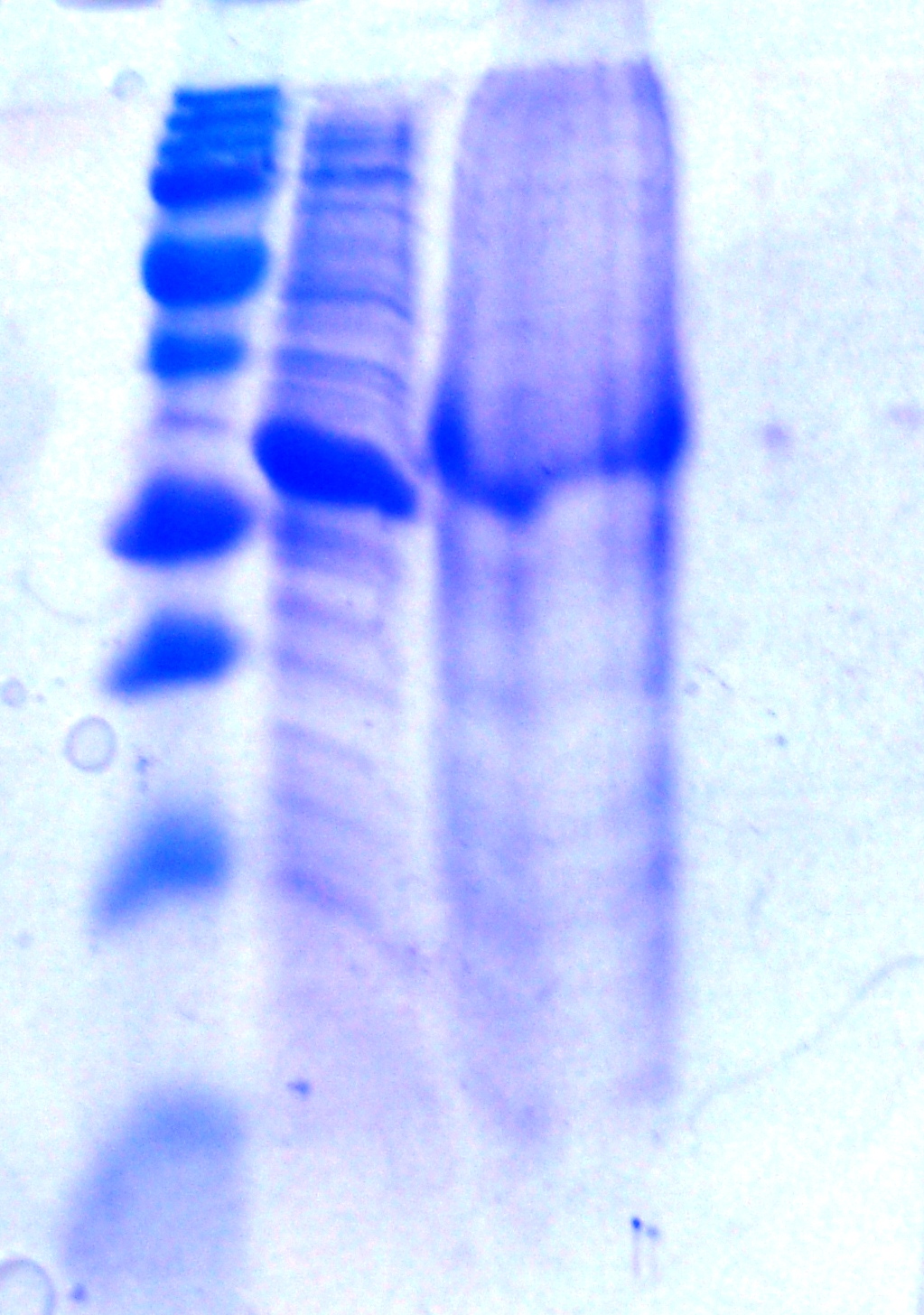
37 кДа
50 кДа
исунок _ - Растворение телец включения в буфере с 3.5 М гуанидингидрохлоридом.Б
25 кДа
елковый маркерОтмытые тельца включения
Р
20 кДа
астворение буфером № 4
15 кДа
(Смотри метод 1.9.17 )
10 кДа
1 2 3
Во время денатурации важно, чтобы белок сохранял вторичную структуру. Это является важным фактором с точки зрения эффективности рефолдинга, так как это связано с функциональной способностью молекулы ренатурировать в правильном направлении.
Растворенный гибридный белок в буфере с 3.5 М гуанидингидрохлоридом в дальнейшем использовался для очистки при помощи металло-хелатной аффинной хроматографии.
2.3.2 Металло-хелатная аффинная хроматография
SUMO, входящий в состав гибридного белка, содержит последовательность из шести гистидинов (His-таг). Очистка белков, содержащих полигистидиновые последовательности, в техническом плане имеет ряд преимуществ перед белками, не содержащими такие последовательности. Так становится возможным применение металло –хелатной аффинной хроматографии (МХАХ), в основе которой лежит образование прочного комплекса, образующегося между His6-последовательностью и ионами металла (чаще всего Ni2+ или Co2+), которыми заряжен хроматоргафический носитель.
На колонку, уравновешенную буфером А, наносили подготовленный образец, после чего промывали колонку тем же буфером А. При этом происходило отмывание всех не связавшихся с колонкой белков E. coli. Все не специфически связавшиеся бактериальные белки удалялись с колонки при повышении концентрации имидазола. Для элюции были опробованы буферы B и С, с содержанием имидазола 50 и 500 мМ соответственно (Рисунок _ ).
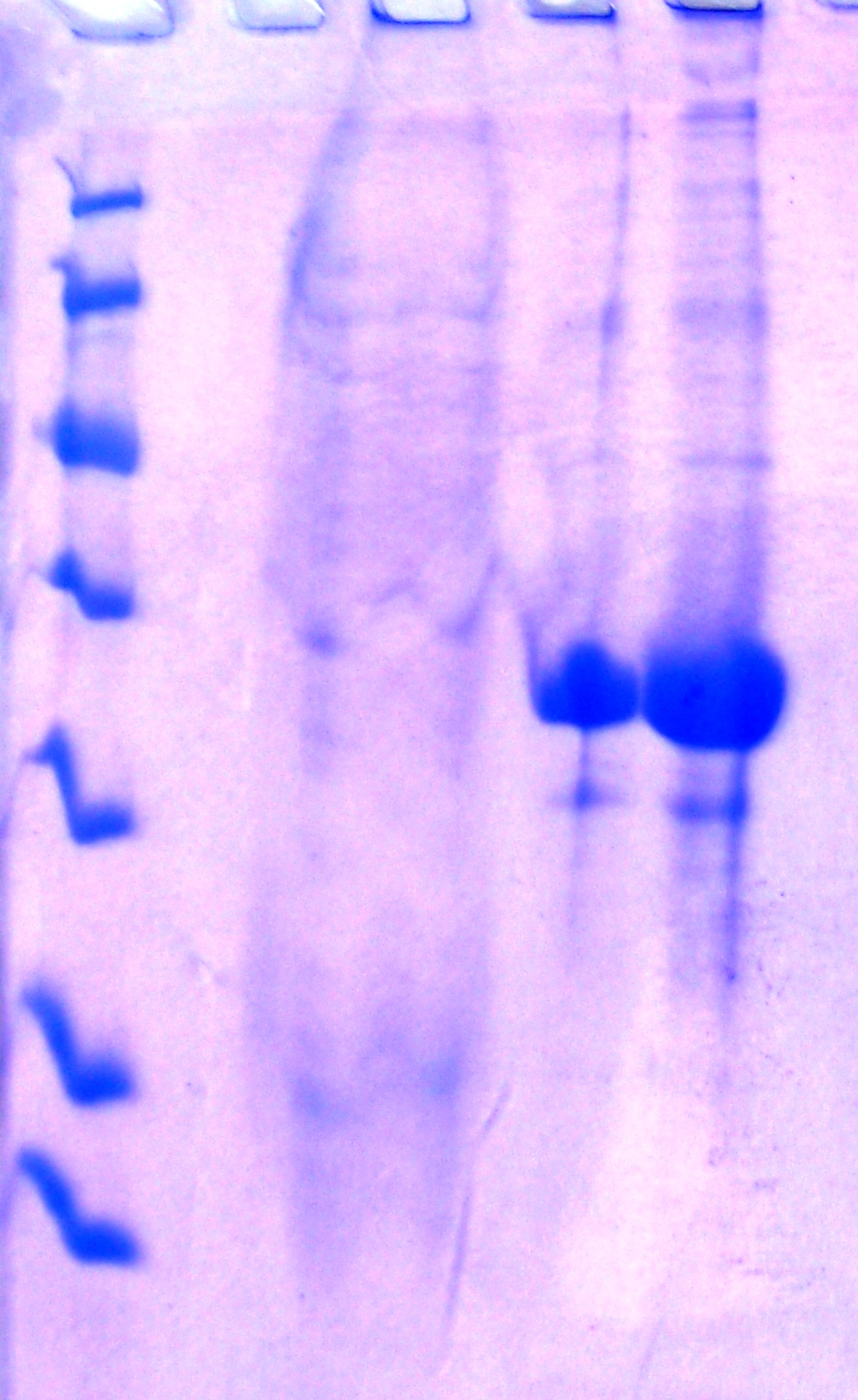
75 кДа
1 2 3 4 Рисунок _ - Очистка белка с помощью МХАХБ
50 кДа
елковый маркерП
37 кДа
роскокЭ
25 кДа
люция № 1Элюция № 2
10 кДа
20 кДа
Из рисунка _ видно, что основная часть рекомбинантного белка сходит при элюции с концентрацией имидазола 500 мМ. Использование высокой концентрации имидазола позволяет снизить концентрацию NaCl в буфере для элюции с 500 мМ до 150 мМ, что необходимо для дальнейшего рефодинга рекомбинантного белка.
