- •Э.А. Янко
- •Производство алюминия
- •Пособие для мастеров и рабочих цехов
- •Электролиза алюминиевых заводов
- •Предисловие
- •Глава 1 теоретические основы производства алюминия
- •Общие положения
- •Электрохимия процесса электролиза
- •Расчет основных производственных показателей алюминиевого электролизера
- •Электролит
- •Процессы на аноде и катоде
- •Побочные процессы на аноде и катоде
- •Другие побочные процессы на аноде и катоде
- •Пропитка угольной футеровки
- •Факторы, способствующие повышению выхода по току и производительности электролизера
- •Оценка абсолютных потерь выхода по току, %
- •Глава 2 сырьё, применяемое в производстве алюминия
- •2.1. Глинозём
- •Классификация глинозёма по физическим свойствам
- •Требования к глинозёму
- •2.2. Фтористые соли
- •Требования к техническому криолиту
- •Требования к техническому фтористому алюминию
- •Глава 3 конструкция алюминиевых электролизеров, их монтаж и демонтаж
- •3.1. Общая характеристика и классификация электролизеров
- •3.2. Анодное устройство
- •3.3. Катодное устройство
- •3.4. Футеровка катодного кожуха
- •3.5. Ошиновка
- •3.6. Сбор анодных газов и укрытие электролизёра
- •3.7. Электрическая изоляция
- •3.8. Монтаж и демонтаж электролизеров
- •Глава 4 обжиг и пуск электролизёров
- •4.1. Общие положения
- •4.2. Обжиг подины
- •4.2.1. Обжиг новых серий электролизёров
- •4.2.2. Обжиг ванн после капитального ремонта
- •4.3. Пуск ванн на электролиз
- •4.4. Обслуживание ванн в период после пуска
- •Глава 5 работа электролизёра в нормальном технологическом режиме
- •5.1. Общие положения
- •5.2. Температура электролита
- •5.3. Состав электролита, уровни металла и электролита
- •5.4. Регулирование состава электролита по температуре ликвидуса, перегрев электролита
- •5.5. Междуполюсное расстояние (мпр).
- •5.6. Форма рабочего пространства
- •5.7. Гашение анодных эффектов
- •5.8. Технологическое обслуживание электролизеров
- •5.9. Тепловые и энергетические балансы алюминиевых электролизёров
- •Глава 6 нарушения нормального хода электролизёра и пути их уСтранения
- •6.1. Горячий ход
- •6.2. Холодный ход ванны
- •6.3. «Зажатие» междуполюсного расстояния. Работа ванны «в борт»
- •6.4. Образование карбидов
- •6.5. Природа «шумов» и их устранение
- •6.6. Аварийные случаи в работе ванн
- •Глава 7 основы формирования и технологического обслуживания анодов
- •7.1. Самообжигающиеся аноды
- •7.1.1. Механизм формирования самообжигающихся анодов
- •7.1.2. Электрические характеристики
- •7.1.3. Технология самообжигающегося анода при использовании «сухой» анодной массы
- •7.1.4. Технология обслуживания анодов
- •7.1.5. Требования к качеству анодной массы
- •Технические требования к качеству анодной массы
- •7.1.6. Нарушения нормальной работы анодов
- •7.2. Обожженные аноды
- •7.2.1. Требования к качеству обожженных анодов
- •Перечень показателей качества по системе iso
- •7.2.2. Термическая устойчивость обожженных анодов
- •7.2.3. Особенности эксплуатации обожженных
- •7.2.4. Аноды с пазами
- •7.2.5. Обслуживание анодов
- •График замены анодов
- •Результаты измерений для вариантов схем замены анодов
- •7.2.5. Укрытие анодного массива
- •Ситовой состав укрывного материала, %
- •Глава 8 газоочистка и регенерация криолита
- •8. 1. Сбор и транспортировка анодных газов
- •8.2. Очистка газа
- •8.3. Производство криолита из растворов газоочистки
- •8.4. Извлечение криолита из угольной пены
- •Глава 9 энергоснабжение электролизных серий. Механизация и автоматизация процесса электролиза
- •9.1. Энергоснабжение электролизных серий
- •9.2. Механизация процессов обслуживания электролизеров.
- •9.3. Автоматическая система управления технологическим процессом (асутп)
- •9.4. Централизованная раздача и автоматизированное питание ванн глинозёмом
- •9.4.1. Общие положения
- •9.4.2. Конструкция систем апг
- •9.4.3. Автоматизированное управление работой апг
- •9.4.4.Управление питанием электролизёра при
- •9.4.5. Внутризаводская транспортировка глинозёма. Системы централизованной раздачи глинозёма (црг)
- •Глава 10 первичный алюминий как сырьё для переработки в товарные виды продукции
- •10.1. Алюминий-сырец и способы его рафинирования
- •Химический состав товарного алюминия, % ( примесей металлов, % не более)
- •10.2. Расчёт шихты для получения товарного алюминия
- •10.3. Первичная переработка алюминия-сырца
- •10.4. Сплавы на основе алюминия
- •Химический состав силуминов, % (max) *
- •10.5. Управление технологическим процессом
- •Список использованной литературы
- •Оглавление
- •Глава 2 42
- •Глава 3 50
- •Глава 4 91
- •Глава 5 105
- •Глава 7 163
- •Глава 9 240
Глава 1 теоретические основы производства алюминия
Общие положения
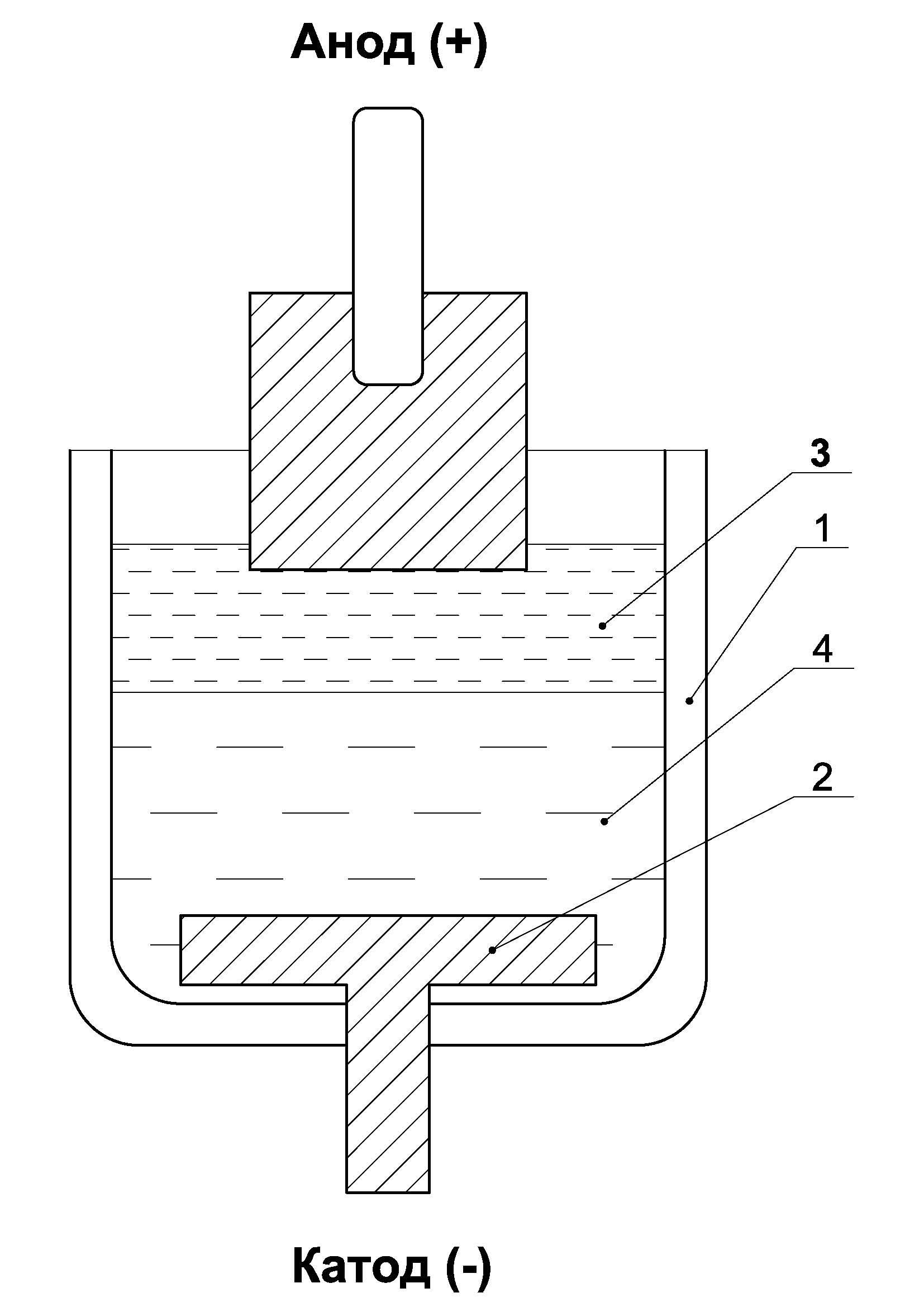
Современное производство алюминия основано на электролитическом разложении глинозема (Al2O3) с выделением на катоде металлического алюминия, а на аноде – газообразных продуктов электролиза. На рис.1.1 схематически изображена электролитическая ячейка, в которой можно произвести электролиз криолитоглинозёмных расплавов.
Все содержимое ячейки размещается в керамическом тигле 1. Со стороны дна установлена графитовая пластина 2, к которой подведен отрицательный полюс от источника постоянного тока (катод). В верхней части ячейки помещается угольный анод, к которому подведен положительный полюс источника тока. Анод погружается в расплавленный электролит 3, роль которого заключается, во-первых, в образовании токопроводящей среды между катодом и анодом, во-вторых, в растворении глинозема.
Последний фактор весьма важен, т.к. он позволяет растворить порошковый оксид алюминия в жидкой фазе, где становится возможным его электролитическое разложение. В электролите Al2O3 диссоциирует на положительные ионы алюминия (катионы) и отрицательные кислородсодержащие ионы (анионы). Ниже слоя электролита размещается расплавленный алюминий 4, фактически выполняющий роль катода.
Присоединим ячейку к положительному и отрицательному полюсам источника тока и в цепи появится прямой электрический ток, т.е. поток электрических зарядов. В металлических проводниках и графите ток переносится за счет электронов (проводники I-го рода), а в жидких электропроводящих средах (электролитах) – за счет ионов (проводники II-го рода). Проводники I-го рода, подводящие ток к электролитам, называют электродами.
Электрический ток, проходящий через электролит, вызывает в электролите химические изменения. Этот процесс носит название электролиза. В нашей ячейке на катоде появляются избыточные электроны (е-), которые захватываются катионами алюминия и приводят к его восстановлению по реакции
Al3+ + 3е- = Al
На аноде происходит поглощение электронов от отрицательно заряженных анионов. В суммарном виде анодная реакция может быть записана в следующем виде:
2О2- - 4е- + С = СО2
|
Рис. 1.1. Схема электролитической ячейки |
Образовавшийся на катоде алюминий, будучи по удельному весу тяжелее электролита, накапливается на дне ячейки и в последующем выполняет функции катода. Углекислый газ за счёт взаимодействия с углеродом анода частично восстанавливается по реакции СО2 + С = 2СО и свободно удаляется от анода в систему газоотсоса. Добавим к этому, что в качестве электролита алюминиевой ячейки повсеместно используется криолит, имеющий формулу смеси двух солей 3NaF AlF3 или в суммарном виде Na3AlF6. |
Криолит в расплавленном состоянии хорошо растворяет глинозем и достаточно электропроводен для использования в электролизе. Электролит по удельному весу легче металла, поэтому он находится над поверхностью алюминия в виде расплавленного слоя.
В таком виде способ производства алюминия электролизом глинозема в расплаве криолита был изобретен одновременно двумя инженерами П.Эру (Франция) и Ч.Холлом (США) в 1886г. и до настоящего времени в принципе сохраняется неизменным.
Агрегат для промышленного производства алюминия носит название алюминиевого электролизера или алюминиевой ванны (рис.1.2). В конструкцию электролизера заложены те же основные принципы, что и в элементарной ячейке на рис.1.1. Содержимое электролизёра – расплавленный электролит и алюминий находятся в ванне, ограниченной угольной подиной и бортовой футеровкой. Ниже подины размещена футеровка из огнеупорного и теплоизоляционного материалов. Ток к подине подводится с помощью стальных стержней (блюмсов), соединенных с катодной ошиновкой. Через анодную ошиновку ток подводится к анодному устройству и непосредственно к угольным анодам. Анод находится в полупогруженном состоянии в электролите, расстояние между анодом и расплавленным алюминием носит название междуполюсного расстояния (МПР).
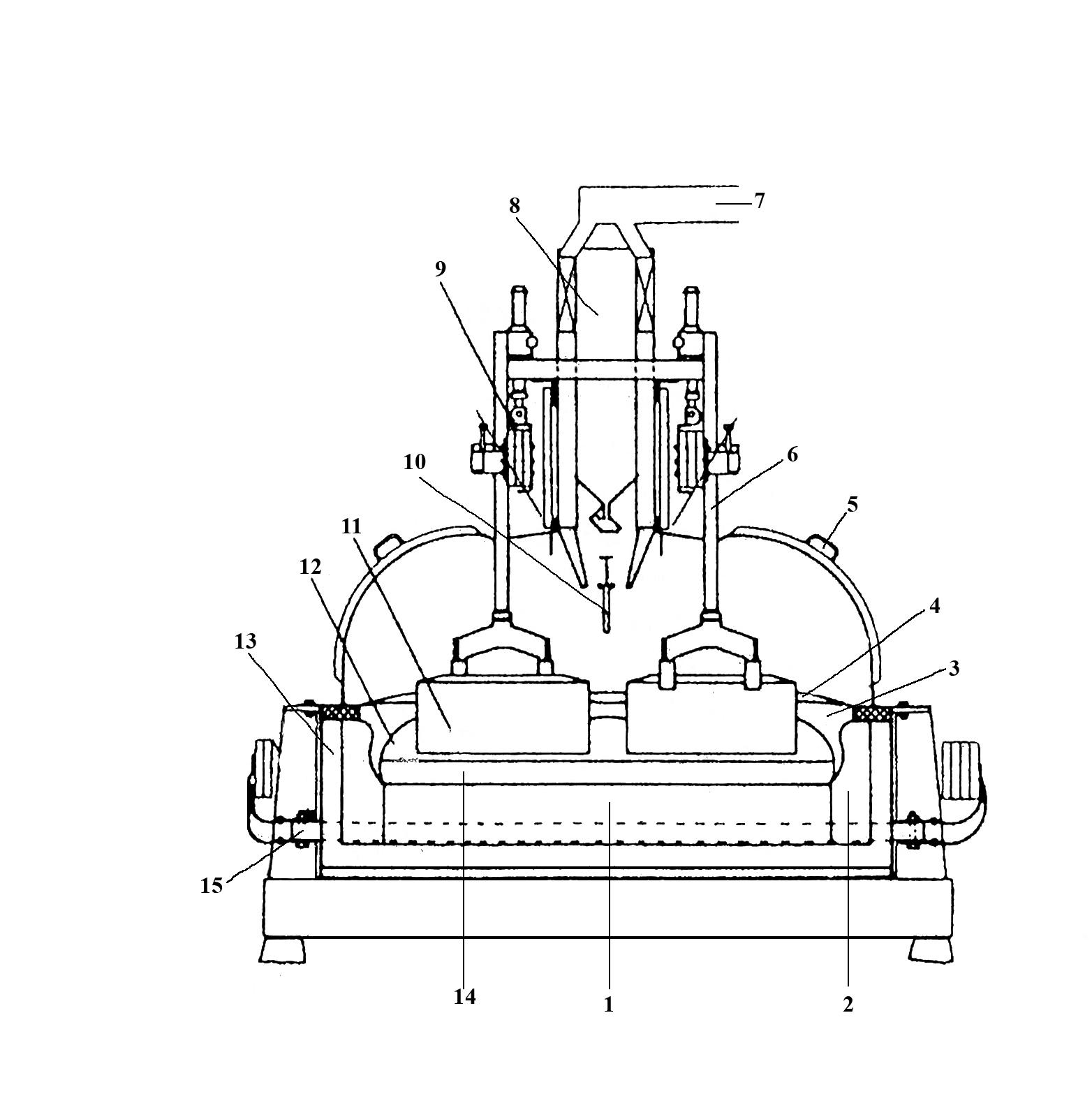
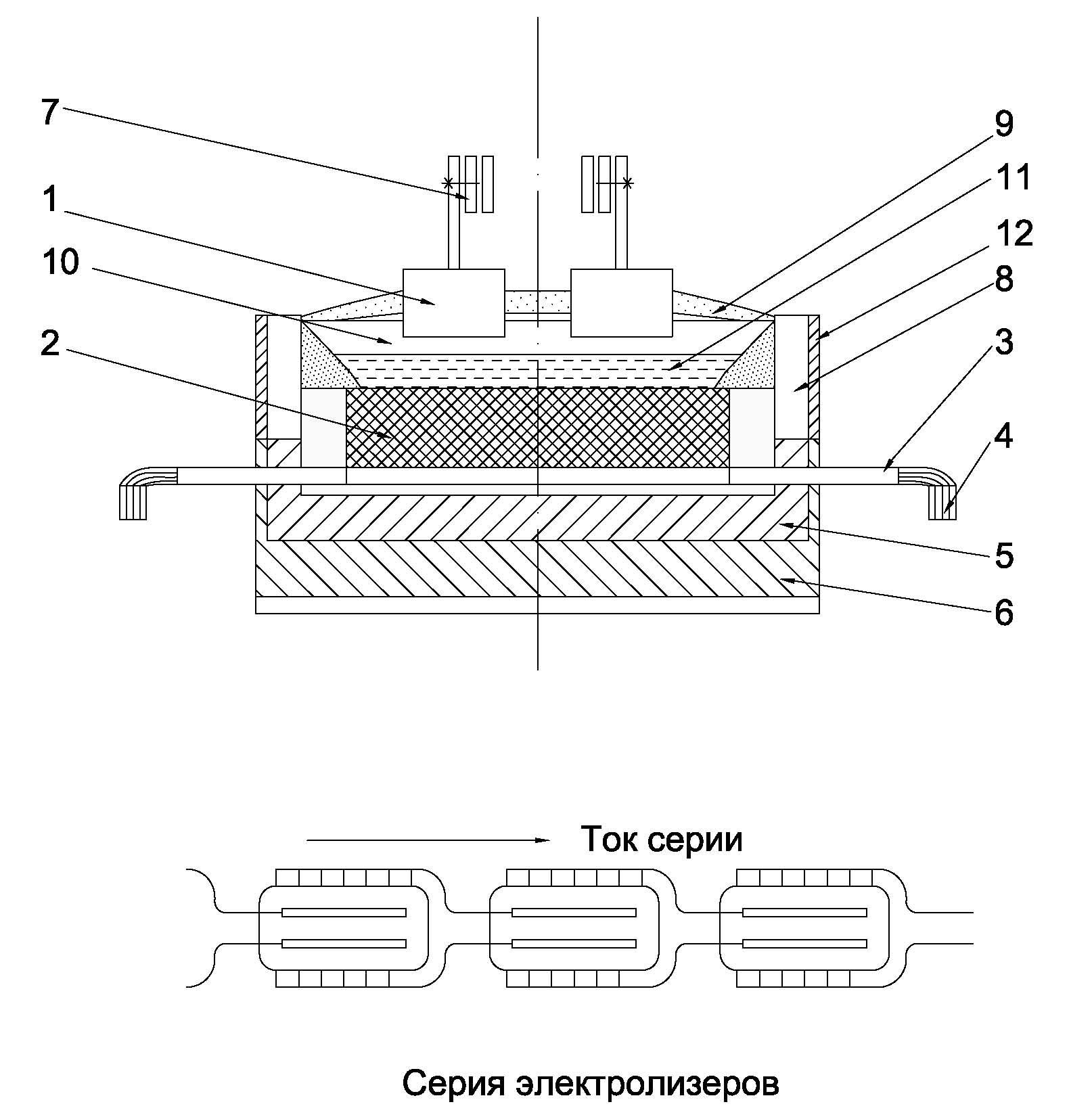
Рис. 1.2. Схема алюминиевого электролизёра:
1-угольная футеровка; 2-бортовые блоки; 3-бортовая настыль;
4-укрывной материал; 5-съёмные крышки; 6-анододержатели;
7-коллектор анодных газов; 8-бункер глинозёма;
9-анодная шина; 10-пробойник АПГ; 11-анод;
12-электролит; 13-бортовая теплоизоляция; 14-расплавленный
алюминий; 15-блюмс