
- •Міністерство аграрної політики та продовольства України
- •Аналіз ґрунтів
- •Аналіз води
- •2. Обладнання лабораторії
- •2.1. Лабораторне устаткування
- •2.2. Хімічний посуд
- •2.3. Лабораторні прилади
- •2.4. Інше приладдя
- •2.5. Підготовка посуду до аналізу
- •2.6. Одержання дистильованої води
- •2.7. Вимоги до чистоти хімічних реактивів
- •2.8. Зберігання різних хімічних реактивів
- •3. Зважування на різних типах терезів
- •3.1. Класифікація терезів
- •3.2. Будова аналітичних та технічних терезів
- •3.3. Загальні правила зважування та роботи на аналітичних терезах типу w
- •3.4. Загальні правила зважування та роботи на технохімічних терезах типу влкт – 500
- •4. Техніка виконання аналітичних робіт
- •4.1. Класифікація аналітичних методів
- •4.2. Виконання операцій в напівмікроаналізі
- •4.3. Лабораторне обладнання, що використовують в напівмікроаналізі
- •5. Виготовлення розчинів різної концентрації
- •5.1. Класифікація розчинів
- •5.2. Приготування розчинів з відсотковою концентрацією
- •100 Г розчину містить 77,6 г кислоти
- •5.4. Приготування розчинів з молярною концентрацією
- •100 Г розчину містить 50 г кислоти
- •5.5. Приготування розчинів із фіксаналів
- •6. Якісний та кількісний аналіз
- •6.1. Характеристика якісного аналізу
- •6.2. Характеристика кількісного аналізу
- •7. Характеристика інструментальних методів аналізу
- •7.1. Колориметричний аналіз
- •7.2. Полуменево–фотометричний аналіз
- •7.3. Потенціометричний аналіз
- •7.4. Рефрактометричний аналіз
- •7.5. Поляриметричний аналіз
- •Аналіз ґрунтів
- •8. Відбір зразків грунту та підготовка їх до аналізу
- •8.1. Суть грунтово–агрохімічного обстеження сільськогосподарських угідь
- •8.2. Вимоги до елементарних ділянок
- •8.3. Підготовчі роботи до обстеження ріллі, сіножатей, пасовищ
- •8.4. Спорядження для проведення польових робіт
- •8.5. Періодичність та строки відбору ґрунтових зразків
- •8.6. Відбір зразків ґрунту на ріллі
- •8.7. Особливості відбору зразків закритого ґрунту
- •8.8. Специфіка грунтово–агрохімічного обстеження селянських фермерських господарств, присадибних та садово–городніх ділянок
- •8.9. Документація на ґрунтові зразки, відібрані при агрохімічному обстеженні сільськогосподарських угідь
- •8.10. Складання агрохімічних картограм і еколого–агрохімічних паспортів полів. Узагальнення результатів грунтово–агрохімічного обстеження с.Г. Угідь
- •9. Характеристика різних типів вологи в грунті
- •10. Вміст азоту, фосфору і калію в ґрунті
- •11. Вміст гумусу в грунті
- •Аналіз води
- •12. Джерела водопостачання
- •13. Відбір проб питної води
- •14. Органолептичні показники якості природної води
- •15. Фізичні показники води
- •16. Хімічні показники води
- •Аналіз рослин
- •17. Загальна характеристика проб
- •18. Відбір зразків рослин для аналізу
- •19. Підготовка зразків рослин для аналізу
- •20. Вміст води і сухої речовини у рослинах
- •Аналіз добрив
- •21. Характеристика мінеральних і органічних добрив
- •22. Відбір проб мінеральних добрив
- •23. Відбір проб рідких та твердих органічних добрив
- •24. Відбір і підготовка проб торфу до аналізу
- •Аналіз кормів
- •25. Характеристика силосу
- •26. Вимоги до якісних показників силосу
- •27. Характеристика сінажу
- •28. Вимоги до якісних показників сінажу
- •29. Характеристика комбікормів
- •30. Вимоги до якісних показників комбікормів
- •31. Відбір середніх проб різних кормів
- •Аналіз сільськогосподарської продукції
- •32. Аналіз продукції рослинництва
- •32.1. Оцінка якості зерна хлібних культур
- •32.2. Оцінка якості олійних культур
- •33. Аналіз продукції тваринництва
- •33.1 Хімічний склад молока
- •33.2 Біохімічні властивості молока
- •33.3 Фізичні властивості молока
- •33.4 Відбір середньої проби молока
- •33.5 Зберігання проб молока
- •33.6 Органолептичні показники молока
- •33.7 Види фальсифікації молока
5.2. Приготування розчинів з відсотковою концентрацією
-
Відсоткова концентрація (%) – чисельно дорівнює кількості грамів розчиненої хімічної сполуки, що міститься в 100 грамах розчину.
Приклад 1. Необхідно приготувати 95 мл 15% розчину гідроксиду калію (КОН).
Розрахунок проводять згідно з пропорцією:
100 г розчину містить 15 г КОН
95 г розчину містить х г КОН
отже:
![]()
Розрахунок розчинника проводимо так: 95 – 14,25 = 80,75 мл.
Відповідь: для приготування 95 мл 15% розчину КОН потрібно взяти 14,25 г КОН і 80,75 мл дистильованої води.
Приклад 2. Необхідно приготувати 700 л 20% розчину CuSO4 із кристалогідрату CuSO4 · 5Н2О.
Розрахунок проводять згідно з пропорцією:
100 г розчину містить 20 г CuSO4
700 г розчину містить Х г CuSO4
звідки:
![]()
Але слід враховувати, що в кристалогідраті міститься певна кількість води і тому потрібно робити перерахунок.
Молекулярна маса CuSO4 = 159,6 Молекулярна маса CuSO4· 5Н2О = 249,6
Тому:
159,6 г CuSO4 міститься в 249,6 г CuSO4 · 5Н2О
140 г CuSO4 міститься в містить Х г CuSO4 · 5Н2О
звідки:
![]()
Розрахунок розчинника проводимо так: 700 – 218,9 = 481,1 мл.
Відповідь: для приготування 700 мл 20% розчину CuSO4 потрібно розчинити 218,9г CuSO4 · 5Н2О в 481,1 мл дистильованої води.
Приклад 3. Необхідно приготувати 550 мл 15% розчину (Н2SО4, ρ = 1.819)
Розрахунок проводять згідно з пропорцією:
100 г розчину містить 15 г Н2SО4
550 г розчину містить Х г Н2SО4
звідки:
![]()
Враховуючи те, що початковий 90% розчин Н2SО4 містить у 100 г 90 г безводневої сірчаної кислоти, знаходимо, скільки грам розчину відповідає 82,50 гр Н2SО4.
100 г розчину містить 90 г Н2SО4
х г розчину містить 82,5 г Н2SО4
![]()
Об’єм концентрованої кислоти становить:
![]()
Розрахунок розчинника проводимо так: 550 – 50,36 = 499,64 мл.
Відповідь: для приготування 550 г 15% розчину сірчаної кислоти потрібно взяти 50,39 мл Н2SО4 і 499,61 мл дистильованої води.
5.3. Приготування розчинів з нормальною концентрацією
-
Нормальна концентрація виражається кількістю еквівалентних мас речовини, що міститься в 1 л (1000 мл) розчину.
Еквівалент хімічної сполуки чисельно дорівнює її еквівалентній масі в реакції, але виражається у грамах.
Еквівалентна маса елемента дорівнює його молярній масі, поділеній на валентність.
Еквівалентна маса оксиду дорівнює його молекулярній масі, поділеній на кількість атомів кисню, помножених на 2, або сумі еквівалентних мас кисню та елемента. Наприклад, еквівалентна маса оксиду алюмінію дорівнює:

Еквівалентна маса кислоти дорівнює її молекулярній масі, поділеній на основність кислоти в цій реакції, або сумі еквівалентних мас кислотного залишку і водню. Наприклад, еквівалентна маса сірчаної кислоти дорівнює:
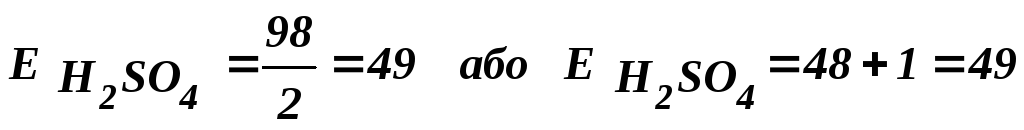
Еквівалентна маса основи дорівнює її молекулярній масі, поділеній на кількість гідроксильних груп, що беруть участь у цій реакції. Наприклад, еквівалентна маса Al2(OH)3 дорівнює :

Еквівалентна маса іона дорівнює його молярній масі, поділеній на величину його заряду без урахування знака заряду. Наприклад, еквівалентні маси іона алюмінію і сульфат–іона дорівнюють:

Еквівалентна маса солі дорівнює її молярній масі, поділеній на добуток кількості атомів металу в молекулі на його валентність у цій солі, або сумі еквівалентних мас катіона та аніона. Наприклад, еквівалентна маса сульфату алюмінію дорівнює:

Приклад 4. Необхідно приготувати 1,5 л 0,5Н розчину сірчаної кислоти (77,6% розчин).
Розраховуємо еквівалентну масу сірчаної кислоти:
![]()
Розраховуємо масу кислоти, яка потрібна для приготування розчину:
![]() ;
;
![]()
Перераховуємо, в якій наважці 77,6 % розчину сірчаної кислоти міститься 36,78 г безводневої H2SO4:
