
- •1. Терминология,
- •2. Энергетика процессов
- •3. Критерии направленности процессов и равновесия
- •4. Химическое равновесие
- •1. Терминология, основные понятия и определения
- •1.1. Термодинамическая система
- •1.2. Термодинамические параметры
- •1.3. Термодинамический процесс и термодинамическое равновесие
- •1.4. Функции пути осуществления процесса и функции состояния
- •1.5. Химический процесс и химическая переменная
- •1.6. Модели идеальных систем в химической термодинамике. Реальные системы
- •2. Энергетика процессов
- •2.1. Первое начало термодинамики (постулат о существовании внутренней энергии)
- •2.2. Термодинамическая работа
- •2.3. Внутренняя энергия и теплота
- •2.4. Энтальпия
- •2.5. Взаимосвязь работы и теплоты с изменениями внутренней энергии и энтальпии в изопроцессах с участием идеального газа
- •2.6. Теплоёмкость
- •2.7. Фазовые переходы I рода
- •2.8. Зависимость теплоёмкости от температуры
- •Простых веществ
- •2.9. Зависимость внутренней энергии и энтальпии от температуры
- •2.10. Зависимость внутренней энергии, энтальпии и теплоемкости от давления
- •2.11. Изменение внутренней энергии и энтальпии в химических реакциях
- •2.12. Экспериментальные методы определения тепловых эффектов химических реакций
- •2.13. Стандартные тепловые эффекты
- •2.14. Зависимость теплового эффекта от температуры. Уравнение Кирхгофа
- •Температуры:
- •2.15. Интегрирование уравнения Кирхгофа
- •2.16. Зависимость энтальпии реакции от давления
- •3. Критерии направленности процессов и равновесия в системах постоянного и переменного составов
- •3.1. Второе начало термодинамики (постулат о существовании энтропии)
- •3 .1.1.С в о и ств а энтропии. Энтропия как критерий направленности самопроизвольных процессов и равновесия в изолированных системах
- •3.1.2. Связь энтропии с параметрами
- •3.1.4. Изменение энтропии при обратимых фазовых переходах I рода
- •3.1.5. Статистическое толкование энтропии. Уравнение б ольцма иа -Пл анка
- •3.1.7. Расчет абсолютных значений энтропии
- •Абсолютной энтропии
- •3.1.8. Изменение энтропии в химических
- •3.2. Критерии направленности процессов и равновесия в неизолированных системах
- •3.2.1. Объединенное уравнение первого и второго начал термодинамики
- •3.2.4. Зависимости энергии Гиббса и энергии Гельмгольца от основных параметров состояния
- •Веществ
- •Веществ
- •Веществ
- •Веществ
- •При наличии фазовых превращений
- •3.2.7. Уравнения г и б б с а-г е л ь м г о л ь ц а
- •3.2.8. Вывод уравнений для зависимостей термодинамических функций от давления и объема
- •3.2.9. О "сложности" преобразований при выводе уравнений химической термодинамики
- •Функций по параметрам состояния
- •3.3. Критерии направленности процессов и равновесия в системах переменного состава
- •3.3.1. Химический потенциал
- •3.3.2. Свойства химического потенциала
- •3.3.3. Химический потенциал моля идеального газа
- •3.3.4. Химический потенциал компонента смеси идеальных газов
- •4. Химическое равновесие
- •4.1. Химическое равновесие в смеси идеальных
- •4.2. Расчет стандартного химического сродства
- •4.3. Стандартное химическое сродство и термодинамическая константа равновесия как характеристики равновесного состояния
- •4.4. Химическое сродство как критерий направленности процесса
- •4.5. Зависимость константы равновесия от температуры
- •4.5.1. Дифференциальная форма уравнений изобары и изохоры химической реакции
- •4.6. Расчет термодинамической константы равновесия
- •4.6.1. Общая характеристика фонда справочных данных
- •4.6.2. Способы расчета термодинамической константы равновесия
- •4 . 7 . 1.Реа к ц и и в смесях газов.
- •Связь термодинамической константы равновесия с
- •Эмпирическими (концентрационными) константами
- •Равновесия:Кр', кх,кп,кс
- •4.7.2.Реакции в гомогенной конденсированной фазе (реакции в растворах)
- •4.7.3. Реакции в гетерогенных системах
- •4.8. Расчет состава равновесной смеси по величине термодинамической константы равновесия
- •4.8.1.Химическое превращение представлено единственным уравнением
- •4.8.2.Химическое превращение представлено двумя уравнениями
- •4.8.3. Множественные реакции
- •4.9. Влияние различных факторов на состав
2.9. Зависимость внутренней энергии и энтальпии от температуры
В разделе 2.6. уже отмечалось, что по физическому смыслу Cv и СР являются, соответственно, температурными коэффициентами внутренней энергии и энтальпии:

Это означает, что для нахождения температурной зависимости внутренней энергии и энтальпии необходимо провести интегрирование функции, выражающей зависимость теплоемкости от температуры. Такая процедура выполнима, если внутри рассматриваемого интервала температур функция не имеет разрывов, что реализуется при условии неизменности фазового состояния вещества (или системы веществ). В этом случае:
42
[p# 47]


Так как при всех температурах теплоемкость индивидуальных веществ больше нуля (нагревание вещества всегда сопровождается поглощением энергии), то внутри области существования любой фазы как внутренняя энергия, так и энтальпия монотонно возрастают с температурой.
Если же в интервале температур (Т2 - Т]) фазовое состояние вещества изменяется, то уравнения для расчета AU и АН будут включать слагаемые,
учитывающие вклад теплоёмкостной составляющей, и слагаемые, связанные с энергетическими изменениями, имеющими место при фазовых превращениях.
В простейшем случае при наличии одного фазового перехода I рода (например, плавления) изменение энтальпии вычисляется по уравнению:
 *
*
которое включает энтальпию плавления и интегралы, соответствующие изменениям энтальпии кристаллической фазы при нагревании от Tj до Тпл и жидкой фазы от Тпл до Т2.
В общем же случае, когда внутри интервала T2-Ti могут существовать несколько фаз, следует учесть энтальпии всех фазовых превращений и взять интегралы, характеризующие изменение энтальпии при нагревании каждой из фаз, существующих в рассматриваемом температурном интервале:

Нахождение зависимости внутренней энергии от температуры выполняется по аналогичной процедуре с учетом того, что:
[p# 48]
2. Энергетика 43
[p# 49]
для газов Cv = Cp-R;
для конденсированных фаз: Су~ Ср;
для фазовых переходов: Аф.пи = Лф.пН~рЛфпУ
На практике интегрирование удобно проводить графически, представив теплоемкость как функцию температуры (рис.6) с учетом разрывов, обусловленных фазовыми переходами, и аномалий в окрестностях фазовых переходов II рода (если, разумеется, такие переходы происходят).

Рис.6. Интегрирование температурной зависимости теплоёмкости NH4NO3 (р=1атм) с целью нахождения высокотемпературных составляющих энтальпии в интервалах температур (0 - 500 К) и (298,15 - 500 К )
Уравнение, выражающее зависимость энтальпии в интервале 0-500 К, имеет вид:

2. Энергетика
44
[p# 50]
Для интервала температур 298-500 К оно не содержит слагаемых, относящихся к области низких температур:

На рис. 7 приведены температурные зависимости энтальпии воды и свинца.
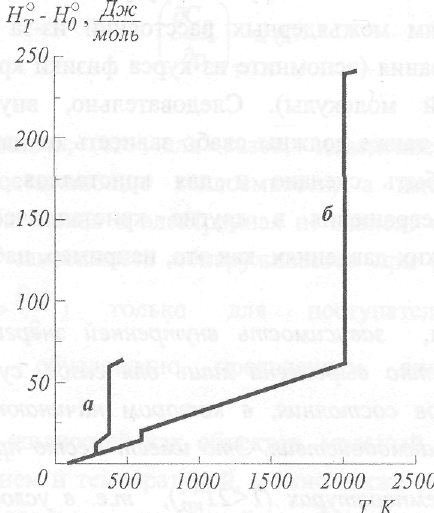
Рис.7 Температурная зависимость (р=1атм) энтальпии воды (а) и свинца (б)
Обратите внимание, что на шкале ординат указана не абсолютная энтальпия, а разность НТ-Щ. Малое отклонение зависимости H=f(T) от
линейности, наблюдаемое для жидкого свинца, указывает на слабую зависимость теплоемкости от температуры (наклон зависимости H=f(T) равен
теплоемкости). Можно отметить также, что для фазовых переходов справедливо неравенство: АПЛН «ДпарообрН, которое выражено тем сильнее, чем больше
разность между температурами плавления и кипения.
2. Энергетика
45
[p# 46]
