
- •1. Терминология,
- •2. Энергетика процессов
- •3. Критерии направленности процессов и равновесия
- •4. Химическое равновесие
- •1. Терминология, основные понятия и определения
- •1.1. Термодинамическая система
- •1.2. Термодинамические параметры
- •1.3. Термодинамический процесс и термодинамическое равновесие
- •1.4. Функции пути осуществления процесса и функции состояния
- •1.5. Химический процесс и химическая переменная
- •1.6. Модели идеальных систем в химической термодинамике. Реальные системы
- •2. Энергетика процессов
- •2.1. Первое начало термодинамики (постулат о существовании внутренней энергии)
- •2.2. Термодинамическая работа
- •2.3. Внутренняя энергия и теплота
- •2.4. Энтальпия
- •2.5. Взаимосвязь работы и теплоты с изменениями внутренней энергии и энтальпии в изопроцессах с участием идеального газа
- •2.6. Теплоёмкость
- •2.7. Фазовые переходы I рода
- •2.8. Зависимость теплоёмкости от температуры
- •Простых веществ
- •2.9. Зависимость внутренней энергии и энтальпии от температуры
- •2.10. Зависимость внутренней энергии, энтальпии и теплоемкости от давления
- •2.11. Изменение внутренней энергии и энтальпии в химических реакциях
- •2.12. Экспериментальные методы определения тепловых эффектов химических реакций
- •2.13. Стандартные тепловые эффекты
- •2.14. Зависимость теплового эффекта от температуры. Уравнение Кирхгофа
- •Температуры:
- •2.15. Интегрирование уравнения Кирхгофа
- •2.16. Зависимость энтальпии реакции от давления
- •3. Критерии направленности процессов и равновесия в системах постоянного и переменного составов
- •3.1. Второе начало термодинамики (постулат о существовании энтропии)
- •3 .1.1.С в о и ств а энтропии. Энтропия как критерий направленности самопроизвольных процессов и равновесия в изолированных системах
- •3.1.2. Связь энтропии с параметрами
- •3.1.4. Изменение энтропии при обратимых фазовых переходах I рода
- •3.1.5. Статистическое толкование энтропии. Уравнение б ольцма иа -Пл анка
- •3.1.7. Расчет абсолютных значений энтропии
- •Абсолютной энтропии
- •3.1.8. Изменение энтропии в химических
- •3.2. Критерии направленности процессов и равновесия в неизолированных системах
- •3.2.1. Объединенное уравнение первого и второго начал термодинамики
- •3.2.4. Зависимости энергии Гиббса и энергии Гельмгольца от основных параметров состояния
- •Веществ
- •Веществ
- •Веществ
- •Веществ
- •При наличии фазовых превращений
- •3.2.7. Уравнения г и б б с а-г е л ь м г о л ь ц а
- •3.2.8. Вывод уравнений для зависимостей термодинамических функций от давления и объема
- •3.2.9. О "сложности" преобразований при выводе уравнений химической термодинамики
- •Функций по параметрам состояния
- •3.3. Критерии направленности процессов и равновесия в системах переменного состава
- •3.3.1. Химический потенциал
- •3.3.2. Свойства химического потенциала
- •3.3.3. Химический потенциал моля идеального газа
- •3.3.4. Химический потенциал компонента смеси идеальных газов
- •4. Химическое равновесие
- •4.1. Химическое равновесие в смеси идеальных
- •4.2. Расчет стандартного химического сродства
- •4.3. Стандартное химическое сродство и термодинамическая константа равновесия как характеристики равновесного состояния
- •4.4. Химическое сродство как критерий направленности процесса
- •4.5. Зависимость константы равновесия от температуры
- •4.5.1. Дифференциальная форма уравнений изобары и изохоры химической реакции
- •4.6. Расчет термодинамической константы равновесия
- •4.6.1. Общая характеристика фонда справочных данных
- •4.6.2. Способы расчета термодинамической константы равновесия
- •4 . 7 . 1.Реа к ц и и в смесях газов.
- •Связь термодинамической константы равновесия с
- •Эмпирическими (концентрационными) константами
- •Равновесия:Кр', кх,кп,кс
- •4.7.2.Реакции в гомогенной конденсированной фазе (реакции в растворах)
- •4.7.3. Реакции в гетерогенных системах
- •4.8. Расчет состава равновесной смеси по величине термодинамической константы равновесия
- •4.8.1.Химическое превращение представлено единственным уравнением
- •4.8.2.Химическое превращение представлено двумя уравнениями
- •4.8.3. Множественные реакции
- •4.9. Влияние различных факторов на состав
3.2.4. Зависимости энергии Гиббса и энергии Гельмгольца от основных параметров состояния
3.2.4.1.Зависимости A = f(V)T и A = f(T)v
Полный дифференциал энергии Гельмгольца может быть представлен в виде:
![]()
С учетом объединенного уравнение первого и второго начал термодинамики:
dU = TdS-pdV приходим к выражению:
![]()
Следовательно, производная энергии Гельмгольца по объему в условиях постоянства температуры равна давлению со знаком минус:
![]()
которая также больше нуля (давление возрастает при сжатии), и это означает, что зависимость A = f(V)T - вогнутая (рис.15).
3. Критерии (G и Н) 91
Поскольку давление всегда больше нуля, то для индивидуальных веществ сжатие должно приводить к уменьшению энергии Гельмгольца. Однако прежде чем представить эту зависимость графически, найдем вторую производную по объему:

[p# 95]

Рис. 15. Графическое представление зависимости A=f(V) для индивидуальных
Веществ
что после интегрирования приводит к уравнению:
Для идеальных газов:
![]()
![]()
В условиях постоянства объема
![]()
и, следовательно, производная энергии Гельмгольца по температуре равна энтропии, взятой со знаком минус:
![]()
Так как для индивидуальных веществ энтропия может быть только
(дВ} больше нуля и всегда возрастает с повышением температуры, т.е. > 0, то
v3TVv
энергия Гельмгольца уменьшается с возрастанием температуры и эта зависимость имеет вид выпуклой кривой (рис. 16).
92
[p# 96]
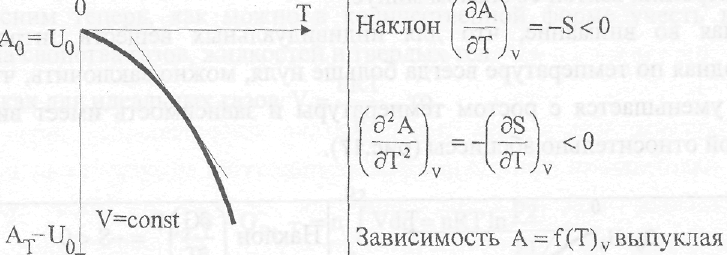
Рис. 16. Графическое представление зависимости A=f(T) для индивидуальных
Веществ
Следует обратить внимание, что по оси ординат откладывается не сама энергия Гельмгольца, а разность Ат ~А0 = Ат -1)0. Дело в том, что
использование нуля как начала отсчета для функции, абсолютное значение
которой неизвестно, возможно лишь при условии, что приводимые значения представляет собой разность АТ-А0. Но так как согласно третьему началу
термодинамики при абсолютном нуле температуры энтропия равна нулю, то ао ~ U0 и, следовательно,
![]()
3.2.4.2.Зависимости G = f(T)p и G-f(p)T
Запишем выражение для полного дифференциала энергии Гиббса:
![]()
![]()
Так как dU = TdS - pdV, то
dG - TdS - pdV + pdV + Vdp - TdS - SdT = Vdp - SdT
Следовательно,
при постоянстве давления производная
энергии Гиббса по температуре:![]()
3. Критерии (О и Н)
[p# 97]
равна энтропии, взятой со знаком минус.
Принимая во внимание, что для индивидуальных веществ энтропия и ее производная по температуре всегда больше нуля, можно заключить, что энергия Гиббса уменьшается с ростом температуры и зависимость имеет вид кривой, выпуклой относительно абсциссы (рис.17).

Рис. 17. Графическое представление зависимости G-f(T) для индивидуальных
Веществ
Установим теперь вид зависимости энергии Гиббса от давления в условиях постоянства температуры. Для этого случая имеем:
![]()

< 0 (объем уменьшается при сжатии), то
энергия Гиббса должна возрастать с увеличением давления, и эта зависимость имеет вид выпуклой кривой (рис.18).

Рис. 18. Графическое представление зависимости G=f(p) для индивидуальных
