
- •1. Терминология,
- •2. Энергетика процессов
- •3. Критерии направленности процессов и равновесия
- •4. Химическое равновесие
- •1. Терминология, основные понятия и определения
- •1.1. Термодинамическая система
- •1.2. Термодинамические параметры
- •1.3. Термодинамический процесс и термодинамическое равновесие
- •1.4. Функции пути осуществления процесса и функции состояния
- •1.5. Химический процесс и химическая переменная
- •1.6. Модели идеальных систем в химической термодинамике. Реальные системы
- •2. Энергетика процессов
- •2.1. Первое начало термодинамики (постулат о существовании внутренней энергии)
- •2.2. Термодинамическая работа
- •2.3. Внутренняя энергия и теплота
- •2.4. Энтальпия
- •2.5. Взаимосвязь работы и теплоты с изменениями внутренней энергии и энтальпии в изопроцессах с участием идеального газа
- •2.6. Теплоёмкость
- •2.7. Фазовые переходы I рода
- •2.8. Зависимость теплоёмкости от температуры
- •Простых веществ
- •2.9. Зависимость внутренней энергии и энтальпии от температуры
- •2.10. Зависимость внутренней энергии, энтальпии и теплоемкости от давления
- •2.11. Изменение внутренней энергии и энтальпии в химических реакциях
- •2.12. Экспериментальные методы определения тепловых эффектов химических реакций
- •2.13. Стандартные тепловые эффекты
- •2.14. Зависимость теплового эффекта от температуры. Уравнение Кирхгофа
- •Температуры:
- •2.15. Интегрирование уравнения Кирхгофа
- •2.16. Зависимость энтальпии реакции от давления
- •3. Критерии направленности процессов и равновесия в системах постоянного и переменного составов
- •3.1. Второе начало термодинамики (постулат о существовании энтропии)
- •3 .1.1.С в о и ств а энтропии. Энтропия как критерий направленности самопроизвольных процессов и равновесия в изолированных системах
- •3.1.2. Связь энтропии с параметрами
- •3.1.4. Изменение энтропии при обратимых фазовых переходах I рода
- •3.1.5. Статистическое толкование энтропии. Уравнение б ольцма иа -Пл анка
- •3.1.7. Расчет абсолютных значений энтропии
- •Абсолютной энтропии
- •3.1.8. Изменение энтропии в химических
- •3.2. Критерии направленности процессов и равновесия в неизолированных системах
- •3.2.1. Объединенное уравнение первого и второго начал термодинамики
- •3.2.4. Зависимости энергии Гиббса и энергии Гельмгольца от основных параметров состояния
- •Веществ
- •Веществ
- •Веществ
- •Веществ
- •При наличии фазовых превращений
- •3.2.7. Уравнения г и б б с а-г е л ь м г о л ь ц а
- •3.2.8. Вывод уравнений для зависимостей термодинамических функций от давления и объема
- •3.2.9. О "сложности" преобразований при выводе уравнений химической термодинамики
- •Функций по параметрам состояния
- •3.3. Критерии направленности процессов и равновесия в системах переменного состава
- •3.3.1. Химический потенциал
- •3.3.2. Свойства химического потенциала
- •3.3.3. Химический потенциал моля идеального газа
- •3.3.4. Химический потенциал компонента смеси идеальных газов
- •4. Химическое равновесие
- •4.1. Химическое равновесие в смеси идеальных
- •4.2. Расчет стандартного химического сродства
- •4.3. Стандартное химическое сродство и термодинамическая константа равновесия как характеристики равновесного состояния
- •4.4. Химическое сродство как критерий направленности процесса
- •4.5. Зависимость константы равновесия от температуры
- •4.5.1. Дифференциальная форма уравнений изобары и изохоры химической реакции
- •4.6. Расчет термодинамической константы равновесия
- •4.6.1. Общая характеристика фонда справочных данных
- •4.6.2. Способы расчета термодинамической константы равновесия
- •4 . 7 . 1.Реа к ц и и в смесях газов.
- •Связь термодинамической константы равновесия с
- •Эмпирическими (концентрационными) константами
- •Равновесия:Кр', кх,кп,кс
- •4.7.2.Реакции в гомогенной конденсированной фазе (реакции в растворах)
- •4.7.3. Реакции в гетерогенных системах
- •4.8. Расчет состава равновесной смеси по величине термодинамической константы равновесия
- •4.8.1.Химическое превращение представлено единственным уравнением
- •4.8.2.Химическое превращение представлено двумя уравнениями
- •4.8.3. Множественные реакции
- •4.9. Влияние различных факторов на состав
3.2.9. О "сложности" преобразований при выводе уравнений химической термодинамики
Довольно часто множество формул и выводов, приведенных в предшествующих разделах, вызывает у начинающих изучать химическую термодинамику чувство подавленности. Первопричиной этого является потеря стержневой идеи в логических построениях. Ниже в порядке обобщения изложенного будут воспроизведены некоторые рассмотренные выше ключевые положения учения о термодинамических функциях.
Напомним прежде всего, что основными термодинамическими свойствами индивидуальных веществ и характеристиками процессов, происходящих с их участием являются: внутренняя энергия, энтальпия, теплоемкость, энтропия, энергия Гельмгольца и энергия Гиббса. Все эти функции зависят от основных параметров состояния: температуры, давления и объема. Знание вида этих зависимостей является абсолютно необходимым для химии и химической технологии, поскольку только опираясь на эту информацию представляется возможным прогнозировать результаты воздействия на рассматриваемый процесс того или иного параметра.
3. Критерии (Си Н) 109
Чтобы установить вид этих зависимостей, достаточно знать только фундаментальное уравнение Гиббса:
![]()
[p# 114]
Если же упростить цикл преобразований, то следует запомнить очень ограниченное число опорных уравнений. К ним относятся:
• уравнения, выражающие первое и второе начала термодинамики для обратимых процессов:
А Л
. .
![]() >
>
f
• объединенное уравнение первого и второго начал термодинамики:
![]() ' уравнения,
определяющие термодинамические функции:
' уравнения,
определяющие термодинамические функции:
-
• выражения для полных дифференциалов характеристических функций:
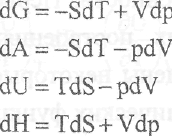
С учетом этого уравнения, выражающие зависимости термодинамических функций (U, Н, С, S, А, и G) от основных параметров состояния, получаются при несложном преобразовании записанных дифференциальных уравнений для характеристических функций с учетом опорных и определительных соотношений химической термодинамики.
В крайнем случае Вы можете воспользоваться мнемоническим способом написания основных уравнений термодинамики, придуманным, как полагают, физиком М. Борном в 1929 г.
Начните с того, что нарисуйте квадрат и затем разделите его на четыре малых квадрата с помощью двух взаимноперпендикулярных линий (рис.21).
[p# 115]
по
[p# 116]

Рис. 21. Мнемоническая схема нахождения производных характеристических
Функций по параметрам состояния
Вертикальную линию, разделяющую исходный квадрат, обозначьте стрелкой идущей сверху вниз, горизонтальную - стрелкой слева направо. Внешние углы малых квадратов обозначьте (двигаясь по часовой стрелке снизу вверх) латинскими буквами в алфавитном порядке: A, G, H, U. Верхний конец вертикальной стрелки обозначьте буквой S, а нижний - буквой Т. Обозначения для горизонтальной стрелки будут соответственно р ~» V. Закончив построения обратите внимание, что каждую из характеристических термодинамических функций окружают ее' естественные переменные:
>
>
 i
i
При записи уравнений, связывающих термодинамические функции с естественными переменными, поступают следующим образом. Если, например, Вас интересует частная производная энергии Гиббса по температуре, то её значение соответствует функции, располагающейся на линии, образующей вертикальную стрелку, т.е. S. Знак функции определяют с помощью направления стрелки: положительное значение параметра отвечает движению по стрелке, отрицательное - против. Таким образом, в интересующем нас случае:
![]()
3. Критерии (G и Н)
ill
[p# 117]
