
- •1.Факторы, влияющие на растворимость газов. В предельно разбавленных растворах растворимость газов пропорциональна их парциальному давлению над раствором -з-н Генри).
- •2.Зависимость растворимости газа от температуры.
- •Соударения молекул газа с поверхностью жидкости
- •3.Факторы,влияющие на растворимость газов в жидкостях
- •Природа растворённого газа и растворителя
- •Давление газа
- •Присутствие др. Вещ-в ( особенно электролитов)
- •4.Типы растворов жидкостей в жидкостях, причины их разнообразия.
- •5.Идеальные растворы. Построение их диаграммы «давление – состав», температура кипения – состав.
- •6.Вывод зависимости давления насыщенного пара смеси от состава жидкой и паровой фаз.
- •7. Реальные р-ры жидкостей неограниченно растворимые друг в друге. Причины отклонения давления паров над раствором от з-на Рауля.
- •8.Диаграммы давление –состав и температура – состав для реaльных растворов
- •9.Первый з-н Канавалова
- •10.Методы разделения смесей. Ректификация.
- •11. Диаграмма состояния р-ров ,образующих азеотропы.2й з-н Коновалова.
- •Термодинамическое док-во II з-на Кановалова
- •12.Диаграмма «давление – состав» и «температура – состав» Жидкости, ограниченно растворимых друг в друге.
- •13.Диаграммы “Давление-состав” и “температура-состав” для жидкостей, взаимно нерастворимых друг в друге.
- •15. Трехкомпанентные системы. Графическое представление. Определение методами Розебома и Гиббса.
- •19.Проводимость в газах, жидкостях и твердых телах. Электропроводность удельная и эквивалентная. Основные полож-я теории сильных эл-тов. Термодтнамика р-ров сильных эл-тов.
- •20. Скорость движ-ния иона,абсолютная ск-сть движ-я иона,подвижность.
- •21. Вывод уравнения, связывающего эквивалентную электропроводность с подвижностями ионов.
- •23.Влияние различных факторов на электропроводность для р-ров сильных электролитов.
- •25. Ионная сила р-ра. Ионный радиус, ионная атмосфера. Электрофоретическое и релаксационное торможение. Эффект Вина,понятие дисперсии электропроводности.
- •26. Активности и коэффициенты активности электролитов. Вычисление средних коэффициентов активности ионов.
- •27. Кондуктометрическое титрование как метод определения точки эквивалентности при титровании, изменения состава растворов для расчета степени диссоциации, констант диссоциации.
- •28. Понятие об электродвижущих силах, полуэлементе, элементе. Термодинамический вывод уравнения для определения электродного потенциала, уравнение Нернста.
- •29. Термодинамика гальванических элементов.
- •30. Водородный скачок потенциала. Стандартные электродные потенциалы.
- •31. Виды гальванических элементов. Электроды 1-го и 2-го рода. Обратимые, необратимые цепи. Знаки эдс-элементов. Вычисление эдс обратимого гальванического элемента.
- •32. Окислительно-восстановительные электроды или редокс-элементы.
- •33. Химические цепи. Уравнение для расчета эдс.
- •34. Концентрационные цепи. Уравнение для расчета эдс
- •35. Диффузионный скачок потенциала.
- •Потенциометрическое титрование. Электрохимические методы определения рН растворов.
- •Основные понятия химической кинетики: молекулярность, скорость реакции (начальная, истинная и средняя), константа скорости.
- •Вывести уравнение Аррениуса. Энергия активации. Предэкспоненциальный множитель. Методы их определения.
- •39. Порядок реакции по реагенту и методы его экспериментального определения. Лимитирующая стадия химического процесса.
- •Вывод интегрального кинетического уравнения для необратимой и обратимой реакции первого порядка.
- •Вывод интегрального кинетического уравнения для необратимой реакции второго порядка.
- •Вывести уравнение кинетики для параллельных реакций.
- •Вывести уравнение кинетики для гомогенной необратимой последовательной реакции первого порядка
- •Вывести уравнение скорости процесса в потоке, режим идеального вытеснения в стационарных условиях.
- •45. Кинетика гомогенных реакций первого порядка, протекающих в условиях идеального перемешивания.
- •Теория активных соударений и расчет скорости по числу соударений.
- •47. Теория переходного состояния и вывод основного уравнения.
- •50.Кинетика р-ий с неразветвленными цепями.
- •51.Вывод кинетических уравнений цепных р-ий в стационарном приближении
- •52.Пределы воспламенения и взрыва. Механизмы вопламенения.
- •53. Связь кинетики и макрокинетики при протекании экзотермических реакций (теория теплового взрыва)
- •Теория теплового взрыва была разработана в работах Зельдовича и Франк-Каменецкого. Кратко рассмотрим анализ теплового режима в случае сильно экзотермической реакции.
- •Где cp и r означают молярную теплоемкость и плотность газообразной смеси. Окончательное выражение для критической температуры t* имеет вид
- •55.Особенности кинетики р-ий в р-рах. Влияние природы р-рителя на скорость процесса, ур-ие Бренстеда.
- •56. Влияние ионной силы и давления на кинетику реакций в растворе.
- •Если в бимолекулярной реакции реагенты а и в представляют собой ионы с зарядами zА и zВ, и заряд ак z* в линейном приближении равен сумме
- •Тогда из выражения (5.7) можно выразить влияние ионой силы j на константу скорости реакции в растворе:
- •Или для водных растворов
- •58.Общий и специфич. Кислотно-основ.Катализ.
- •59.Катализ комплексами переходных металлов и ферментатив.Катализ.
- •63.Температурная зависимость наблюдаемой скорости реакции
- •70.Топохимические реакции.
26. Активности и коэффициенты активности электролитов. Вычисление средних коэффициентов активности ионов.
Активность связана с химическим
потенциалом компонента раствора
уравнением:
![]()
Индекс х указывает, что активность относится к раствору, в котором концентрация вещества выражена в молярных долях. Активность также иногда называют эффективной или действующей концентрацией.
Коэффициент активности – мера отклонения свойств раствора от св-в идеального раствора той же концентрации.
![]() ,
где γ – мольный коэф. активности,
,
где γ – мольный коэф. активности,
Возможны сопоставления активностей компонентов с концентрациями, выраженными в других единицах:
-
мольно-объемные концентрации (с)
![]() ,
где f
– мольный коэффициент активности
,
где f
– мольный коэффициент активности
-
моляльность (m)
![]() где γ’ – практический
коэффициент активности
где γ’ – практический
коэффициент активности
В общем случае свойства различных ионов в растворе неодинаковы и можно ввести и рассмотреть термодинамические функции для ионов различного типа:
-
Рассмотрим 2-х компонентный раствор, состоящий из растворителя и соли, диссоциирующей по уравнению:
![]()
-
Хим. потенциал:
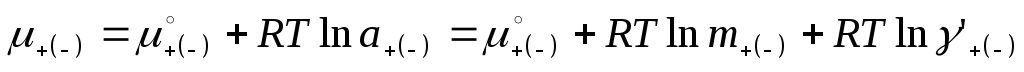 -
-
(2 уравнения К+ и А-)
-
Сделаем предположения:
- взято 1000г растворителя, n1=1000/M1, n2=m – моляльность
- электролит диссоц. нацело:
![]()
- T,P = const, по ур-ю Гиббса-Дюгема (изм-е хим. потенц-ов комп-ов р-ра при изм-ии состава р-ра):
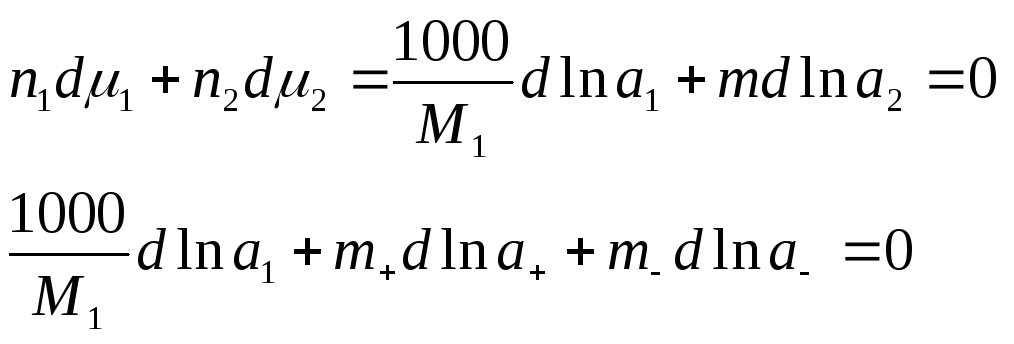 - вычтем из 1-го 2-ое:
- вычтем из 1-го 2-ое:
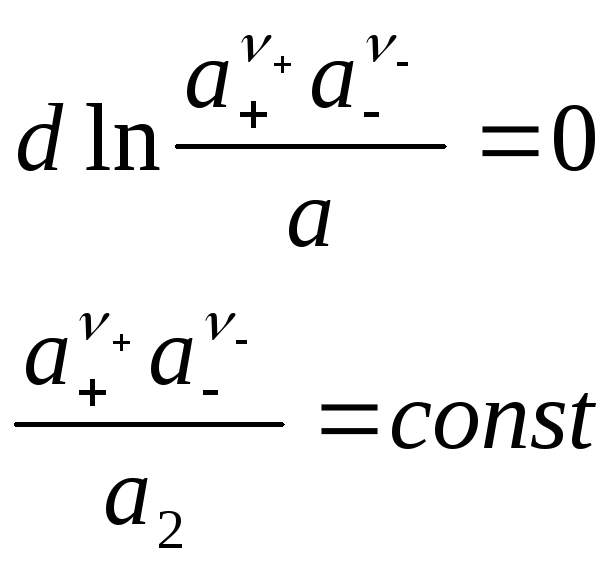
- введем среднюю ионную активность
![]() ,
где
,
где
![]() ;
;
|
|
- опытным путем получают a2 и определяют a по ур-ю;
- вводят сред. ион. коэф. активности и срен. ион. моляльность m:
![]() ;
;
![]()
![]()
![]() - можно выразить практич.коэф.актив.
- можно выразить практич.коэф.актив.
-
Определение активности летучего вещества по парциальному давлению его пара.
Из уравнений: р1=р*1а1, р2=р*2а2, (где р1 – парциальное давление пара растворителя над раствором, р*1 – давление пара над жидким растворителем; р2, р*2 – соответственно для растворенного вещества) получаем
![]()
(индекс 1 указывает номер выбранного стандартного состояния)
Для определения γ твердого растворенного вещества выбираем второе стандартное состояние
![]()
(у – вспомогательная расчетная величина, К2 – константа Генри)
Получаем:
![]()
(где у=у0 при х2→0 находят графическим способом).
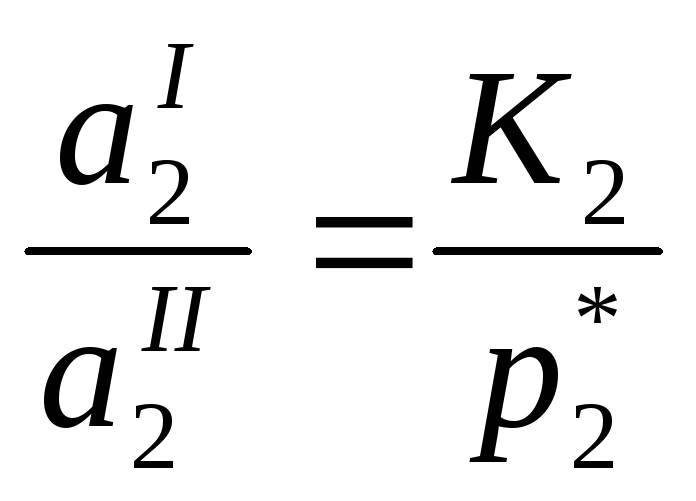
-
Определение активности растворенного вещества по давлению пара растворителя.
Из уравнения Гиббса-Дюгема:
![]()
Интегрирование дает:
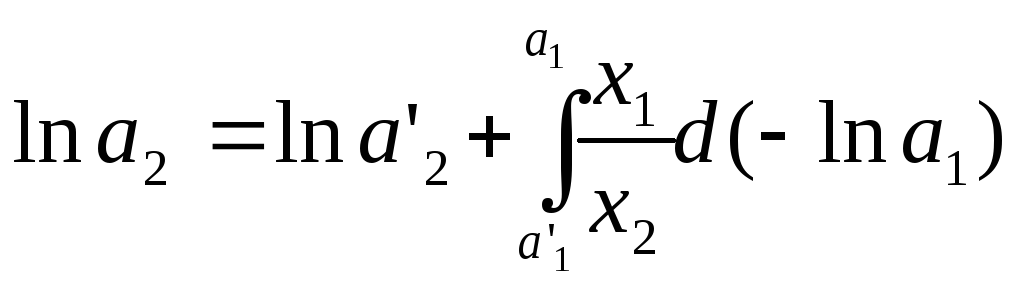 ,
,
где а’1 и a’2 – активности растворителя и растворенного вещества при составе раствора х'2, они должны быть известны.
Также можно проинтегрировать уравнение Гиббса-Дюгема, выраженное через γ:
![]()
Активность а1 определяют по давлению пара над растворами разного состава. Интеграл вычисляют графически.
-
Определение активности растворенного вещества по коэфф. распределения.
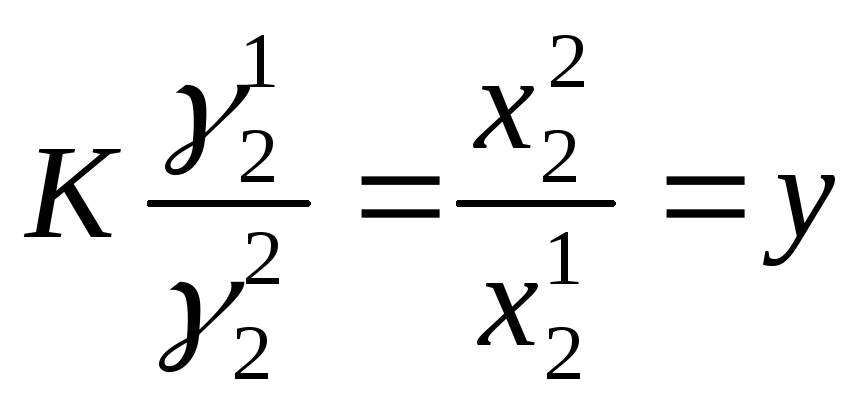
(где К – коэф. распределения, γ12, γ22 - коэффициенты активности растворенного вещества в первом и втором растворителях, х11, х22 - концентрации растворенного вещества в первом и втором растворителях).
а и γ можно вычислять также по понижению температуры замерзания, по повышению температуры кипения, по осмотическому давлению и по др. свойствам растворов.
