
- •1.Факторы, влияющие на растворимость газов. В предельно разбавленных растворах растворимость газов пропорциональна их парциальному давлению над раствором -з-н Генри).
- •2.Зависимость растворимости газа от температуры.
- •Соударения молекул газа с поверхностью жидкости
- •3.Факторы,влияющие на растворимость газов в жидкостях
- •Природа растворённого газа и растворителя
- •Давление газа
- •Присутствие др. Вещ-в ( особенно электролитов)
- •4.Типы растворов жидкостей в жидкостях, причины их разнообразия.
- •5.Идеальные растворы. Построение их диаграммы «давление – состав», температура кипения – состав.
- •6.Вывод зависимости давления насыщенного пара смеси от состава жидкой и паровой фаз.
- •7. Реальные р-ры жидкостей неограниченно растворимые друг в друге. Причины отклонения давления паров над раствором от з-на Рауля.
- •8.Диаграммы давление –состав и температура – состав для реaльных растворов
- •9.Первый з-н Канавалова
- •10.Методы разделения смесей. Ректификация.
- •11. Диаграмма состояния р-ров ,образующих азеотропы.2й з-н Коновалова.
- •Термодинамическое док-во II з-на Кановалова
- •12.Диаграмма «давление – состав» и «температура – состав» Жидкости, ограниченно растворимых друг в друге.
- •13.Диаграммы “Давление-состав” и “температура-состав” для жидкостей, взаимно нерастворимых друг в друге.
- •15. Трехкомпанентные системы. Графическое представление. Определение методами Розебома и Гиббса.
- •19.Проводимость в газах, жидкостях и твердых телах. Электропроводность удельная и эквивалентная. Основные полож-я теории сильных эл-тов. Термодтнамика р-ров сильных эл-тов.
- •20. Скорость движ-ния иона,абсолютная ск-сть движ-я иона,подвижность.
- •21. Вывод уравнения, связывающего эквивалентную электропроводность с подвижностями ионов.
- •23.Влияние различных факторов на электропроводность для р-ров сильных электролитов.
- •25. Ионная сила р-ра. Ионный радиус, ионная атмосфера. Электрофоретическое и релаксационное торможение. Эффект Вина,понятие дисперсии электропроводности.
- •26. Активности и коэффициенты активности электролитов. Вычисление средних коэффициентов активности ионов.
- •27. Кондуктометрическое титрование как метод определения точки эквивалентности при титровании, изменения состава растворов для расчета степени диссоциации, констант диссоциации.
- •28. Понятие об электродвижущих силах, полуэлементе, элементе. Термодинамический вывод уравнения для определения электродного потенциала, уравнение Нернста.
- •29. Термодинамика гальванических элементов.
- •30. Водородный скачок потенциала. Стандартные электродные потенциалы.
- •31. Виды гальванических элементов. Электроды 1-го и 2-го рода. Обратимые, необратимые цепи. Знаки эдс-элементов. Вычисление эдс обратимого гальванического элемента.
- •32. Окислительно-восстановительные электроды или редокс-элементы.
- •33. Химические цепи. Уравнение для расчета эдс.
- •34. Концентрационные цепи. Уравнение для расчета эдс
- •35. Диффузионный скачок потенциала.
- •Потенциометрическое титрование. Электрохимические методы определения рН растворов.
- •Основные понятия химической кинетики: молекулярность, скорость реакции (начальная, истинная и средняя), константа скорости.
- •Вывести уравнение Аррениуса. Энергия активации. Предэкспоненциальный множитель. Методы их определения.
- •39. Порядок реакции по реагенту и методы его экспериментального определения. Лимитирующая стадия химического процесса.
- •Вывод интегрального кинетического уравнения для необратимой и обратимой реакции первого порядка.
- •Вывод интегрального кинетического уравнения для необратимой реакции второго порядка.
- •Вывести уравнение кинетики для параллельных реакций.
- •Вывести уравнение кинетики для гомогенной необратимой последовательной реакции первого порядка
- •Вывести уравнение скорости процесса в потоке, режим идеального вытеснения в стационарных условиях.
- •45. Кинетика гомогенных реакций первого порядка, протекающих в условиях идеального перемешивания.
- •Теория активных соударений и расчет скорости по числу соударений.
- •47. Теория переходного состояния и вывод основного уравнения.
- •50.Кинетика р-ий с неразветвленными цепями.
- •51.Вывод кинетических уравнений цепных р-ий в стационарном приближении
- •52.Пределы воспламенения и взрыва. Механизмы вопламенения.
- •53. Связь кинетики и макрокинетики при протекании экзотермических реакций (теория теплового взрыва)
- •Теория теплового взрыва была разработана в работах Зельдовича и Франк-Каменецкого. Кратко рассмотрим анализ теплового режима в случае сильно экзотермической реакции.
- •Где cp и r означают молярную теплоемкость и плотность газообразной смеси. Окончательное выражение для критической температуры t* имеет вид
- •55.Особенности кинетики р-ий в р-рах. Влияние природы р-рителя на скорость процесса, ур-ие Бренстеда.
- •56. Влияние ионной силы и давления на кинетику реакций в растворе.
- •Если в бимолекулярной реакции реагенты а и в представляют собой ионы с зарядами zА и zВ, и заряд ак z* в линейном приближении равен сумме
- •Тогда из выражения (5.7) можно выразить влияние ионой силы j на константу скорости реакции в растворе:
- •Или для водных растворов
- •58.Общий и специфич. Кислотно-основ.Катализ.
- •59.Катализ комплексами переходных металлов и ферментатив.Катализ.
- •63.Температурная зависимость наблюдаемой скорости реакции
- •70.Топохимические реакции.
27. Кондуктометрическое титрование как метод определения точки эквивалентности при титровании, изменения состава растворов для расчета степени диссоциации, констант диссоциации.
Кондуктометрия- совокупность электро-хим. методов анализа, основанных на измерении электропроводности жидких электролитов, которая пропорциональна их концентрации.
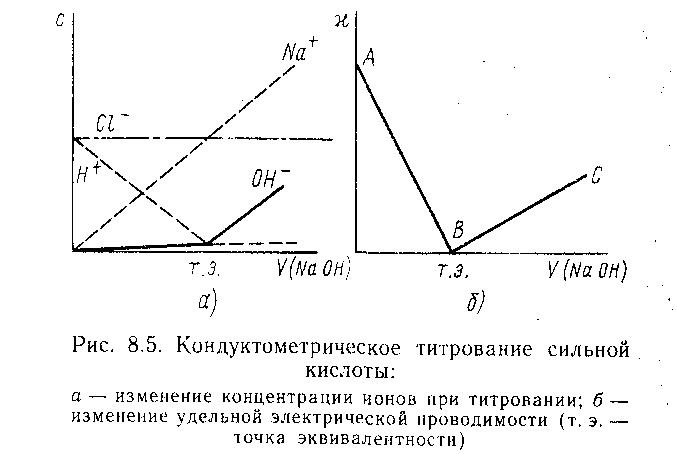
Кондуктометрическое титрование - метод титрования, при котором точку эквивалентности фиксируют по резкому изменению электропроводности исследуемого раствора.
Электропроводность раствора зависит от природы электролита, его концентрации в растворе, природы растворителя и концентрации. Поскольку удельная электропроводность разбавленных растворов пропорциональна концентрации электролита, можно, измеряя электропроводность, определить концентрацию.
Истинная электрическая проводимость р-ра пропорциональна экспериментально измеренной величине ’: =k’, где k – константа сосуда – хар-ка ячейки – зависит от площади электродов, расстояния м/у ними, формы сосуда, объема р-ра, проводящего ток, находят экспериментально станд-ых р-ров, чаще всего КCl.
По экспериментальным данным рассчитываются
значения удельной:
![]()
и эквивалентной
электропроводности:
![]()
Для расчета степени диссоциации слабого электролита используется уравнение:
![]() ,
где λ∞=к+А
- определяется по подвижностям
ионов
,
где λ∞=к+А
- определяется по подвижностям
ионов
Константу диссоциации бинарного
электролита
![]()
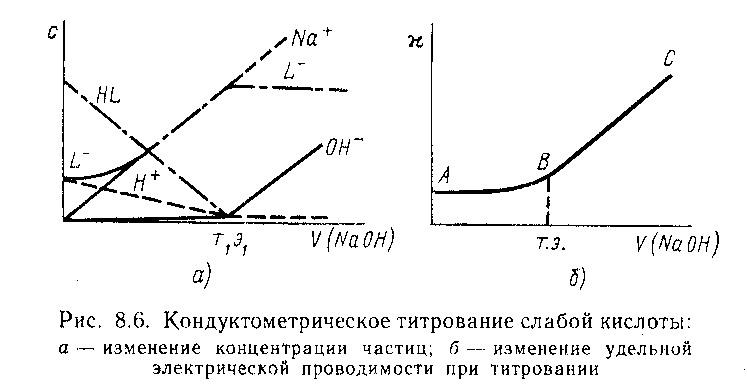
При кондуктометрическом титровании строится кривая зависимости электропроводности титруемого раствора от количества прибавленного титр. агента. Точка эквивалентности определяется по излому кривой этой зависимости. Резкое изменение электрической проводимости происходит, когда в процессе титрования образуются (или исчезают) малодиссоциирующие или труднорастворимые соединения.
Кислотно-основное титрование:
Изменение электрической проводимости до точки эквивалентности будут определяться действием 2-х взаимно противоположных тенденций: за счет сН+, имеющего подвижность 350 Смсм2/(моль-экв), что намного превышает подвижность иона Na+
[50 Смсм2/ (мольэкв)]
После точки эквивалентности начинается резкий электрической проводимости (ветвь ВС), т.к. в растворе будет нарастать концентрация ионов Na+ и ОН-, подвижность кот. составляет 199 Смсм2/ (мольэкв)
28. Понятие об электродвижущих силах, полуэлементе, элементе. Термодинамический вывод уравнения для определения электродного потенциала, уравнение Нернста.
Электрохимия – наука,изучающая химические процессы на электродах и в растворах,которые могут явиться источником электр тока или при действии электр тока определяют электролиз электролита.
В водный раствор электролита можно поместить два металлических электрода, соединить их с внешним источником питания и пропускать через этот электролит электр ток. При прохождении электр тока в растворе и на электродах проходят следующие процессы: перемещение катионов и анионов к электродам, адсорбция их на электродах, окисление аниона и восстановление катиона с передачей электронов по внешней цепи. Таким образом, в системе, содержащей раствор, два электрода и внешний источник тока, электроны перемещаются по внешней цепи, а ионы – по внутренней (раствору). На электродах протекают ОВР, которые определяют как реакции электролиза электролита в водном р-ре.
Можно два электрода,помещенные в растворы разной природы,соединить между собой медной или алюминиевой проволокой в отсутствие внешнего источника тока. На электродах в этом случае также будут протекать ОВР, которые будут являться источником тока. Этот ток можно зафиксировать с помощью амперметра или вольтметра.
В разделе электрохимии изучают отдельно термодинамику электрохимических процессов и кинетику электрохимических процессов, а также влияние физико-химических параметров на эти процессы. Эти процессы изучают в приборе, который называется гальваническим элементом. В гальваническом элементе имеется емкость, разделенная полупроницаемой перегородкой на два отделения. В каждое отделение помещен электрод и раствор электролита, которые соединяются между собой металлическим проводником. Отдельная емкость с раствором соответствующего электролита и электродом называется полуэлементом.
Скачок потенциала, возникающий между заряженной поверхностью электрода и удаленной точкой в растворе называют термодинамическим или нернстовским скачком потенциала. Его величина зависит от природы электрода, температуры и концентрации раствора.
В любом гальваническом элементе работа, получаемая при возникновении тока, будет максимальной. Эта максимальная работа Wmax для превращения 1 моль вещества, которая совершается в гальваническом элементе при постоянных температуре и давлении, равна:
Wmax = z · F · E, где
z - число , участвующих в реакции,
F - постоянная Фарадея (96500 Кл),
Е - ЭДС гальванического элемента.
Максимальная работа химической реакции при стандартных условиях равна изменению стандартного изобарного потенциала реакции:
Wmax = - ΔG0.
Стандартный изобарный потенциал ΔG0 связан с константой равновесия химической реакции Кр уравнением изотермы
- ΔG0 = R · T · ln Кр, где
R - универсальная газовая постоянная (8,314 Дж/моль · К),
Т - температура, К,
Кр - константа равновесия.
Из приведенных формул можно получить следующее уравнение, связывающее ЭДС гальванического элемента с Кр:
z · F · E = R · T · ln Кр,
откуда
![]()
При активности веществ, участвующих в реакции, равной 1 (а = 1)
Е = φ0,
где φ0 - электродный потенциал при стандартных условиях.
φ0 = 0,059 / z · lg Кр.
В общем виде для электродного потенциала в зависимости от концентрации раствора (активности) существует формула Нернста
![]()
где φ - электродный потенциал металла, опущенного в раствор соли с ктивностью катионов аMez+,
z - число валентных электронов,
φ0 - стандартный электродный потенциал металла.
(0,059 при Т = 25°С, 0,058 - при Т = 18°С).
Если электрод - неметалл, посылающий анионы в раствор, то уравнение будет иметь вид:
![]()
ЭДС гальванического элемента будет равна разности электродных потенциалов электродов, составляющих гальванический элемент:
Е = φ1 - φ2,
где φ1 - потенциал положительного электрода,
φ2 - потенциал отрицательного электрода.
![]()
Если заряды ионов одинаковы z = z1 = z2, то уравнение принимает вид:
![]()
где а1 > a2.
Таблицы электродных потенциалов позволяют рассчитать ЭДС гальванического элемента исходя из его электродных потенциалов. С их помощью можно также предсказать, будет ли протекать та или иная окислительно-восстановительная реакция. О стандартном электродном потенциале можно говорить лишь в том случае, когда активность компонентов – участников реакции равна 1, т.е. их концентрация в растворе близка к 1М. Электродный потенциал Е зависит от концентрации окисленной и восстановленной форм в растворе и связан с ними и стандартным потенциалом E° уравнением Нернста. Для обобщенной реакции
ox + ne– = red
это уравнение имеет вид
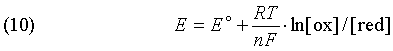
где R – универсальная газовая постоянная, T – абсолютная температура, [ox] и [red] – активности окисленной и восстановленной форм. Активности чистых твердых веществ и жидкостей считаются равными 1. При 25° C RT/F = 0,025 В. Измеряя электродные потенциалы относительно потенциала электрода сравнения, можно с помощью уравнения (10) определять концентрации веществ в растворе; этот метод называется потенциометрией.
