
- •1.Факторы, влияющие на растворимость газов. В предельно разбавленных растворах растворимость газов пропорциональна их парциальному давлению над раствором -з-н Генри).
- •2.Зависимость растворимости газа от температуры.
- •Соударения молекул газа с поверхностью жидкости
- •3.Факторы,влияющие на растворимость газов в жидкостях
- •Природа растворённого газа и растворителя
- •Давление газа
- •Присутствие др. Вещ-в ( особенно электролитов)
- •4.Типы растворов жидкостей в жидкостях, причины их разнообразия.
- •5.Идеальные растворы. Построение их диаграммы «давление – состав», температура кипения – состав.
- •6.Вывод зависимости давления насыщенного пара смеси от состава жидкой и паровой фаз.
- •7. Реальные р-ры жидкостей неограниченно растворимые друг в друге. Причины отклонения давления паров над раствором от з-на Рауля.
- •8.Диаграммы давление –состав и температура – состав для реaльных растворов
- •9.Первый з-н Канавалова
- •10.Методы разделения смесей. Ректификация.
- •11. Диаграмма состояния р-ров ,образующих азеотропы.2й з-н Коновалова.
- •Термодинамическое док-во II з-на Кановалова
- •12.Диаграмма «давление – состав» и «температура – состав» Жидкости, ограниченно растворимых друг в друге.
- •13.Диаграммы “Давление-состав” и “температура-состав” для жидкостей, взаимно нерастворимых друг в друге.
- •15. Трехкомпанентные системы. Графическое представление. Определение методами Розебома и Гиббса.
- •19.Проводимость в газах, жидкостях и твердых телах. Электропроводность удельная и эквивалентная. Основные полож-я теории сильных эл-тов. Термодтнамика р-ров сильных эл-тов.
- •20. Скорость движ-ния иона,абсолютная ск-сть движ-я иона,подвижность.
- •21. Вывод уравнения, связывающего эквивалентную электропроводность с подвижностями ионов.
- •23.Влияние различных факторов на электропроводность для р-ров сильных электролитов.
- •25. Ионная сила р-ра. Ионный радиус, ионная атмосфера. Электрофоретическое и релаксационное торможение. Эффект Вина,понятие дисперсии электропроводности.
- •26. Активности и коэффициенты активности электролитов. Вычисление средних коэффициентов активности ионов.
- •27. Кондуктометрическое титрование как метод определения точки эквивалентности при титровании, изменения состава растворов для расчета степени диссоциации, констант диссоциации.
- •28. Понятие об электродвижущих силах, полуэлементе, элементе. Термодинамический вывод уравнения для определения электродного потенциала, уравнение Нернста.
- •29. Термодинамика гальванических элементов.
- •30. Водородный скачок потенциала. Стандартные электродные потенциалы.
- •31. Виды гальванических элементов. Электроды 1-го и 2-го рода. Обратимые, необратимые цепи. Знаки эдс-элементов. Вычисление эдс обратимого гальванического элемента.
- •32. Окислительно-восстановительные электроды или редокс-элементы.
- •33. Химические цепи. Уравнение для расчета эдс.
- •34. Концентрационные цепи. Уравнение для расчета эдс
- •35. Диффузионный скачок потенциала.
- •Потенциометрическое титрование. Электрохимические методы определения рН растворов.
- •Основные понятия химической кинетики: молекулярность, скорость реакции (начальная, истинная и средняя), константа скорости.
- •Вывести уравнение Аррениуса. Энергия активации. Предэкспоненциальный множитель. Методы их определения.
- •39. Порядок реакции по реагенту и методы его экспериментального определения. Лимитирующая стадия химического процесса.
- •Вывод интегрального кинетического уравнения для необратимой и обратимой реакции первого порядка.
- •Вывод интегрального кинетического уравнения для необратимой реакции второго порядка.
- •Вывести уравнение кинетики для параллельных реакций.
- •Вывести уравнение кинетики для гомогенной необратимой последовательной реакции первого порядка
- •Вывести уравнение скорости процесса в потоке, режим идеального вытеснения в стационарных условиях.
- •45. Кинетика гомогенных реакций первого порядка, протекающих в условиях идеального перемешивания.
- •Теория активных соударений и расчет скорости по числу соударений.
- •47. Теория переходного состояния и вывод основного уравнения.
- •50.Кинетика р-ий с неразветвленными цепями.
- •51.Вывод кинетических уравнений цепных р-ий в стационарном приближении
- •52.Пределы воспламенения и взрыва. Механизмы вопламенения.
- •53. Связь кинетики и макрокинетики при протекании экзотермических реакций (теория теплового взрыва)
- •Теория теплового взрыва была разработана в работах Зельдовича и Франк-Каменецкого. Кратко рассмотрим анализ теплового режима в случае сильно экзотермической реакции.
- •Где cp и r означают молярную теплоемкость и плотность газообразной смеси. Окончательное выражение для критической температуры t* имеет вид
- •55.Особенности кинетики р-ий в р-рах. Влияние природы р-рителя на скорость процесса, ур-ие Бренстеда.
- •56. Влияние ионной силы и давления на кинетику реакций в растворе.
- •Если в бимолекулярной реакции реагенты а и в представляют собой ионы с зарядами zА и zВ, и заряд ак z* в линейном приближении равен сумме
- •Тогда из выражения (5.7) можно выразить влияние ионой силы j на константу скорости реакции в растворе:
- •Или для водных растворов
- •58.Общий и специфич. Кислотно-основ.Катализ.
- •59.Катализ комплексами переходных металлов и ферментатив.Катализ.
- •63.Температурная зависимость наблюдаемой скорости реакции
- •70.Топохимические реакции.
-
Вывести уравнение кинетики для параллельных реакций.
Если исходные вещ-ва реагируют одновременно в нескольких направлениях, то такие реакции наз. параллельными.
А→B скорость
реакции
![]()
А→С скорость реакции
![]()
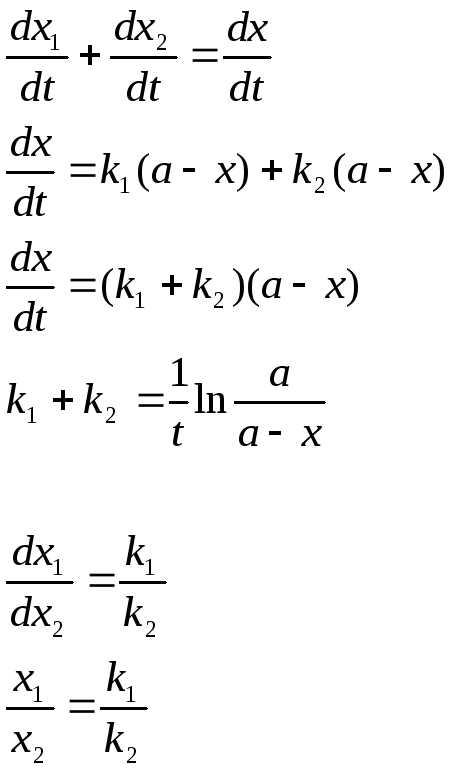
-
Вывести уравнение кинетики для гомогенной необратимой последовательной реакции первого порядка
Это реакции с промежуточными стадиями
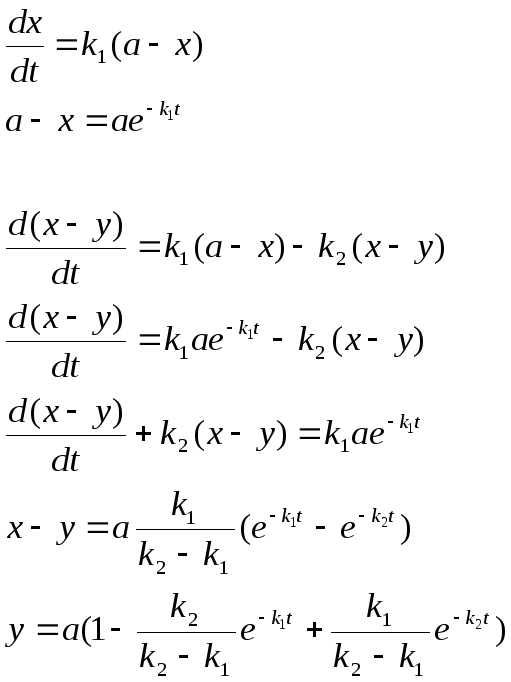
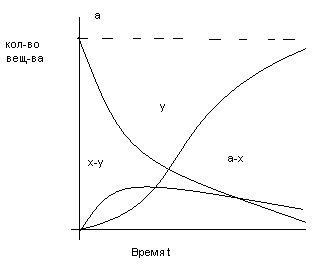
Кривая (x-y) изменения количества промежуточного вещ-ва имеет максимум tmax , при котором наиб. кол-во прмежуточ. вещ-ва
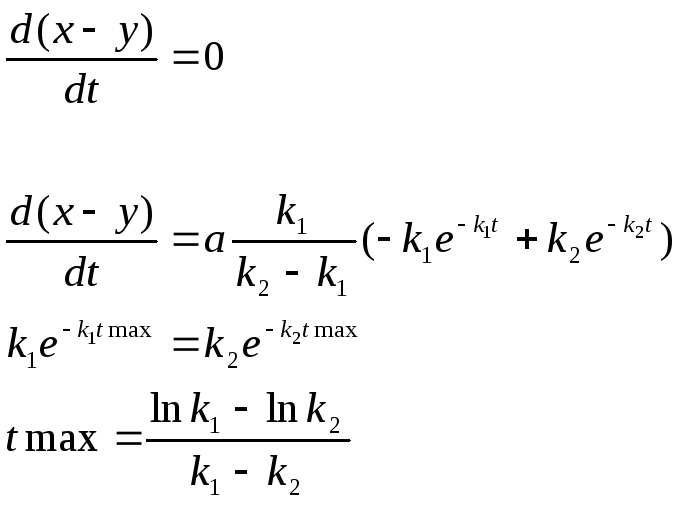
Пусть
![]() тогда
тогда
![]()
![]()
Чем больше k2/k1, тем больше ордината максимума (x-y)
y=f(t) характеризует накопление продукта: точка перегиба(т.е. вещ-во образуется с начальным ускорением) совпадает с точкой максимума (x-y)
-
Вывести уравнение скорости процесса в потоке, режим идеального вытеснения в стационарных условиях.





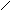
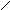 QA
QA
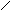 C(0)
C(0)

Рис. 13. Цилиндрический реактор идеального вытеснения: QA – объемная скорость потока, м3/с; dVR – элемент объема реактора, в котором превращается часть вещества dx.
В стационарном режиме в элементе объема накопление вещества не происходит, т.е.
![]() (2.31)
(2.31)
откуда rdVR= QAC(0)dx или, разделяя переменные, получим
dVR/QA = C(0)dx/r (2.32)
Левая часть уравнения 30 это дифференциал от времени пребывания , поэтому с учетом начального условия: при =0, x = 0 найдем общее выражение связи времени пребывания со степенью превращения для реакции, протекающей в реакторе идеального вытеснения:
![]() (2.33)
(2.33)
Для реакции 1-го порядка
r = kCA = kC(0)(1-x) (2.34)
подставим (2.32) в (2.31), и после взятия интеграла, получим выражение
k. = -ln(1-х) (2.35)
аналогичное уравнению (1.21), приведенному в табл. 2.
Для реакции 1-го порядка, протекающей с изменением числа молей:
А В + D
выразим концентрацию реагента через конверсию:
![]() (2.36)
(2.36)
((1+x) в знаменателе появляется из-за увеличения числа молей в реакционной смеси по мере протекания реакции). Подставляя (2.34) в выражение скорости реакции, возьмем интеграл (2.31), который в этом случае имеет вид:
k. = -2ln(1-х) – х (2.37)
45. Кинетика гомогенных реакций первого порядка, протекающих в условиях идеального перемешивания.
Реактор идеального перемешивания является безградиентным, т.е. скорость процесса в реакторе не зависит от тепло- и массопереноса, геометрии реактора, скорости потока и др. макроскопических параметров.
|
С
C
С2 2
|
Рис. 14. Профиль концентрации реагента в объеме реактора идеального перемешивания: C(0) начальная, С1 и С2 текущая концентрация реагента; 2>1 |
|
Объем реактора |




В реакторе идеального перемешивания концентрация исходного вещества уменьшается скачком на входе реакционной смеси в реактор, а смесь на выходе из реактора имеет тот же состав, что и в любой точке внутри реактора. В таком реакторе расчеты существенно упрощаются по причине отсутствия градиентов концентраций – следовательно, не надо интегрировать дифференциальные уравнения. Запишем уравнение материального баланса по исходному веществу А
QA(C0 – CA) – rVR = 0 (2.38)
или вводя время пребывания в реакторе
C0 – CA = τ.rA (2.39)
Разделив (2.37) на C0, получим
x = τ rA/C0 или τ = x C0 / rA (2.40)
Для реакции 1-го порядка rA= kCA кинетическое уравнение в реакторе идеального перемешивания примет конкретный вид:
![]() или
или
![]() (2.41)
(2.41)
или можно записать выражение для конверсии реагента:
![]() (2.42)
(2.42)
Видно, что зависимость х(τ) не содержит величины концентрации, как и в случае протекания реакции в реакторе вытеснения и в статической системе. Таким образом, для реакции 1-го порядка кривые х(τ) (или х(t)) инвариантны к концентрации исходного вещества и типу реактора.



 (0)
(0)



 С1
1
С1
1