
- •1.Факторы, влияющие на растворимость газов. В предельно разбавленных растворах растворимость газов пропорциональна их парциальному давлению над раствором -з-н Генри).
- •2.Зависимость растворимости газа от температуры.
- •Соударения молекул газа с поверхностью жидкости
- •3.Факторы,влияющие на растворимость газов в жидкостях
- •Природа растворённого газа и растворителя
- •Давление газа
- •Присутствие др. Вещ-в ( особенно электролитов)
- •4.Типы растворов жидкостей в жидкостях, причины их разнообразия.
- •5.Идеальные растворы. Построение их диаграммы «давление – состав», температура кипения – состав.
- •6.Вывод зависимости давления насыщенного пара смеси от состава жидкой и паровой фаз.
- •7. Реальные р-ры жидкостей неограниченно растворимые друг в друге. Причины отклонения давления паров над раствором от з-на Рауля.
- •8.Диаграммы давление –состав и температура – состав для реaльных растворов
- •9.Первый з-н Канавалова
- •10.Методы разделения смесей. Ректификация.
- •11. Диаграмма состояния р-ров ,образующих азеотропы.2й з-н Коновалова.
- •Термодинамическое док-во II з-на Кановалова
- •12.Диаграмма «давление – состав» и «температура – состав» Жидкости, ограниченно растворимых друг в друге.
- •13.Диаграммы “Давление-состав” и “температура-состав” для жидкостей, взаимно нерастворимых друг в друге.
- •15. Трехкомпанентные системы. Графическое представление. Определение методами Розебома и Гиббса.
- •19.Проводимость в газах, жидкостях и твердых телах. Электропроводность удельная и эквивалентная. Основные полож-я теории сильных эл-тов. Термодтнамика р-ров сильных эл-тов.
- •20. Скорость движ-ния иона,абсолютная ск-сть движ-я иона,подвижность.
- •21. Вывод уравнения, связывающего эквивалентную электропроводность с подвижностями ионов.
- •23.Влияние различных факторов на электропроводность для р-ров сильных электролитов.
- •25. Ионная сила р-ра. Ионный радиус, ионная атмосфера. Электрофоретическое и релаксационное торможение. Эффект Вина,понятие дисперсии электропроводности.
- •26. Активности и коэффициенты активности электролитов. Вычисление средних коэффициентов активности ионов.
- •27. Кондуктометрическое титрование как метод определения точки эквивалентности при титровании, изменения состава растворов для расчета степени диссоциации, констант диссоциации.
- •28. Понятие об электродвижущих силах, полуэлементе, элементе. Термодинамический вывод уравнения для определения электродного потенциала, уравнение Нернста.
- •29. Термодинамика гальванических элементов.
- •30. Водородный скачок потенциала. Стандартные электродные потенциалы.
- •31. Виды гальванических элементов. Электроды 1-го и 2-го рода. Обратимые, необратимые цепи. Знаки эдс-элементов. Вычисление эдс обратимого гальванического элемента.
- •32. Окислительно-восстановительные электроды или редокс-элементы.
- •33. Химические цепи. Уравнение для расчета эдс.
- •34. Концентрационные цепи. Уравнение для расчета эдс
- •35. Диффузионный скачок потенциала.
- •Потенциометрическое титрование. Электрохимические методы определения рН растворов.
- •Основные понятия химической кинетики: молекулярность, скорость реакции (начальная, истинная и средняя), константа скорости.
- •Вывести уравнение Аррениуса. Энергия активации. Предэкспоненциальный множитель. Методы их определения.
- •39. Порядок реакции по реагенту и методы его экспериментального определения. Лимитирующая стадия химического процесса.
- •Вывод интегрального кинетического уравнения для необратимой и обратимой реакции первого порядка.
- •Вывод интегрального кинетического уравнения для необратимой реакции второго порядка.
- •Вывести уравнение кинетики для параллельных реакций.
- •Вывести уравнение кинетики для гомогенной необратимой последовательной реакции первого порядка
- •Вывести уравнение скорости процесса в потоке, режим идеального вытеснения в стационарных условиях.
- •45. Кинетика гомогенных реакций первого порядка, протекающих в условиях идеального перемешивания.
- •Теория активных соударений и расчет скорости по числу соударений.
- •47. Теория переходного состояния и вывод основного уравнения.
- •50.Кинетика р-ий с неразветвленными цепями.
- •51.Вывод кинетических уравнений цепных р-ий в стационарном приближении
- •52.Пределы воспламенения и взрыва. Механизмы вопламенения.
- •53. Связь кинетики и макрокинетики при протекании экзотермических реакций (теория теплового взрыва)
- •Теория теплового взрыва была разработана в работах Зельдовича и Франк-Каменецкого. Кратко рассмотрим анализ теплового режима в случае сильно экзотермической реакции.
- •Где cp и r означают молярную теплоемкость и плотность газообразной смеси. Окончательное выражение для критической температуры t* имеет вид
- •55.Особенности кинетики р-ий в р-рах. Влияние природы р-рителя на скорость процесса, ур-ие Бренстеда.
- •56. Влияние ионной силы и давления на кинетику реакций в растворе.
- •Если в бимолекулярной реакции реагенты а и в представляют собой ионы с зарядами zА и zВ, и заряд ак z* в линейном приближении равен сумме
- •Тогда из выражения (5.7) можно выразить влияние ионой силы j на константу скорости реакции в растворе:
- •Или для водных растворов
- •58.Общий и специфич. Кислотно-основ.Катализ.
- •59.Катализ комплексами переходных металлов и ферментатив.Катализ.
- •63.Температурная зависимость наблюдаемой скорости реакции
- •70.Топохимические реакции.
50.Кинетика р-ий с неразветвленными цепями.
Рассмотрим кинетику реакций с неразветвленными и разветвленными цепями. Обозначим концентрацию активных частиц «n». Очевидно, что в случае неразветвленной цепной реакции изменения концентрация АЧ изменяется только за счет протекания реакций 1 и 3. Тогда можно выразить скорость изменения концентрации активных частиц (n), определяющую скорость реакции, как:
dn/dt = ri – ktn (4.1)
или если преобладает обрыв цепи в объеме (при повышенных давлениях)
dn/dt = ri – ktn2 (4.2)
где ri – скорость инициирования. Обычно для протекания реакции обрыва не требуется активация (Еt ~ 0) и kt >> ki, поэтому достаточно быстро устанавливается стационарная концентрация активных частиц, определяемая из условия dn/dt = 0 в уравнении (4.1) или (4.2).
На основе рассмотренной феноменологической картины можно описать в стационарном приближении кинетику неразветвленной цепной реакции. Проиллюстрируем это на примере цепной реакции разложения ацетальдегида с образованием метана и монооксида углерода в качестве основных продуктов (также образуется несколько процентов водорода и этана):
СН3СНО СН4 + СО (4.R1)
для которой наблюдается полуторный порядок реакции по ацетальдегиду.
На основании экспериментальных данных можно предложить следующую схему протекания реакции (11):
-
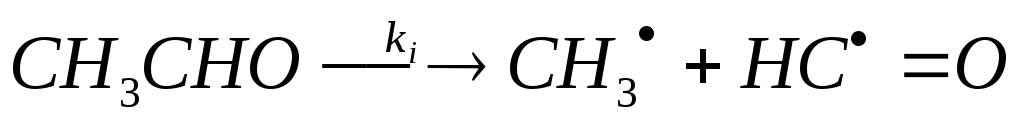 (инициирование
цепи, разрыв связи С-С)
(инициирование
цепи, разрыв связи С-С)
-
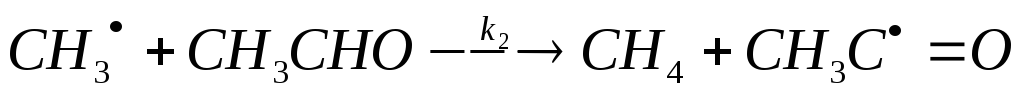 (продолжение
цепи, отрыв атома Н от ацетальдегида)
(продолжение
цепи, отрыв атома Н от ацетальдегида)
-
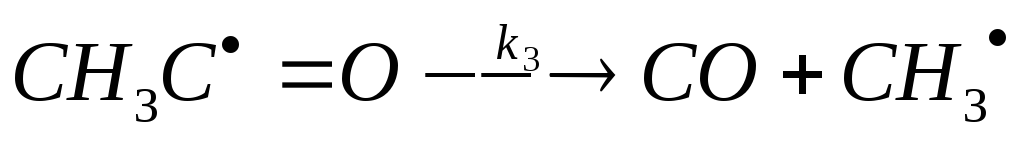 (продолжение
цепи, разрыв связи С-С)
(продолжение
цепи, разрыв связи С-С)
-
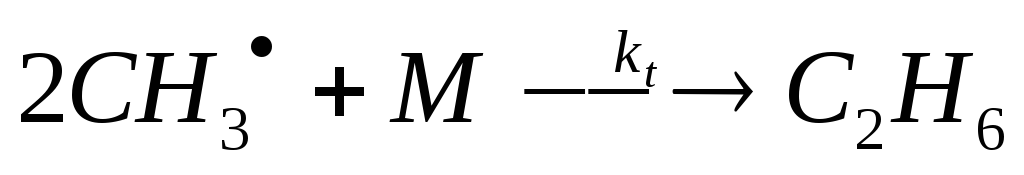 (обрыв цепи)
(обрыв цепи)
Взаимодействием радикалов СН3 + СН3С=О и СН3С=О + СН3С=О пренебрегаем ввиду отсутствия в продуктах ацетона и диацетила. Далее запишем условия стационарности для обоих радикалов, участвующих в продолжении цепи (радикал НС=О обладает низкой активностью):
d[CН3]/dt = kiCA - k2CA[CН3] + k3[СН3С=О]- kt[СН3]2 = 0 (4.3)
d[СН3С=О]/dt = k2CA[CН3] - k3[СН3С=О] = 0 (4.4)
Объединяя (4.3) и (4.4), получим kiCA = kt[СН3]2 , откуда
[СН3] = (kiCA/kt)0,5 (4.5)
Скорость реакции определим по образованию метана (стадия 2)
d[CН4]/dt = k2CA[CН3] (4.6)
или с учетом (4.5) окончательно получим теоретическое кинетическое уравнение
d[CН4]/dt = k2(ki/kt)0,5CA1,5, (4.7)
которое в совокупности со схемой правильно отражает наблюдаемые закономерности.
51.Вывод кинетических уравнений цепных р-ий в стационарном приближении
На основе рассмотренной феноменологической картины можно описать в стационарном приближении кинетику неразветвленной цепной реакции. Проиллюстрируем это на примере цепной реакции разложения ацетальдегида с образованием метана и монооксида углерода в качестве основных продуктов (также образуется несколько процентов водорода и этана):
СН3СНО СН4 + СО (4.R1)
для которой наблюдается полуторный порядок реакции по ацетальдегиду.
На основании экспериментальных данных можно предложить следующую схему протекания реакции (11):
ki
-
СН3СНО СН3 + НС=О (инициирование цепи, разрыв связи С-С)
k2
-
СН3 + СН3СНО СН4 + СН3С=О (продолжение цепи, отрыв атома Н от ацетальдегида)
k3
-
СН3С=О СО + СН3 (продолжение цепи, разрыв связи С-С)
kt
-
2 СН3 + M С2Н6 (обрыв цепи)
Взаимодействием радикалов СН3 + СН3С=О и СН3С=О + СН3С=О пренебрегаем ввиду отсутствия в продуктах ацетона и диацетила. Далее запишем условия стационарности для обоих радикалов, участвующих в продолжении цепи (радикал НС=О обладает низкой активностью):
d[CН3]/dt = kiCA - k2CA[CН3] + k3[СН3С=О]- kt[СН3]2 = 0 (4.3)
d[СН3С=О]/dt = k2CA[CН3] - k3[СН3С=О] = 0 (4.4)
Объединяя (4.3) и (4.4), получим kiCA = kt[СН3]2 , откуда
[СН3] = (kiCA/kt)0,5 (4.5)
Скорость реакции определим по образованию метана (стадия 2)
d[CН4]/dt = k2CA[CН3] (4.6)
или с учетом (4.5) окончательно получим теоретическое кинетическое уравнение
d[CН4]/dt = k2(ki/kt)0,5CA1,5, (4.7)
которое в совокупности со схемой правильно отражает наблюдаемые закономерности
