
- •Министерство здравоохравнения
- •Предисловие
- •Уважаемые школьники!
- •«Медик без довольного познания химии совершен быть не может»! Теоретические основы общей химии
- •Тема 1. Основные понятия и законы химии
- •Типовые задачи с решениями
- •Закон сохранения массы
- •Типовые задачи с решениями
- •Занятие 6. Закон Авогадро и следствия из него
- •6 На занятии проводится тестовый контроль по теме «Типы химических реакций».
- •Типовые задачи с решениями Задача № 1
- •Задача № 2
- •Для нахождения относительной плотности газа надо знать молярные массы: м(газа) и м(н2).
- •Занятие 8. Объемная доля газов в смеси. Молярная доля
- •Типовые задачи с решениями
- •Занятие 9. Вывод формул химических соединений
- •Типовые задачи с решениями
- •Обозначим простейшую формулу РxOy, молекулярную (PxOy)p.
- •1 Способ:
- •2 Способ.
- •3 Способ.
- •Занятие 10, 11
- •Тема 2. Строение атома. Периодический закон, псэ д.И. Менделеева Занятие 12. Строение атома.
- •Типовые задачи с решениями
- •Занятие 13. Строение электронных оболочек атомов
- •Типовые задачи с решениями
- •Символы элементов Электронные формулы
- •6 На занятии проводится тестовый контроль по теме «Строение атома».
- •Занятие 15. Зависимость свойств элементов и их соединений от положения элемента в периодической системе
- •Типовые задачи с решениями
- •Тема 3. Химическая связь Занятие 16. Основные типы химической связи
- •6 На занятии проводится тестовый контроль по теме «Периодический закон и периодическая система д.И. Менделеева».
- •Занятие 17. Строение молекул
- •Типы гибридизации и пространственная конфигурация молекул
- •Типовые задачи с решениями
- •Занятие 18. Ионная, металлическая и водородная связь
- •Типовые задачи с решениями
- •Вещество Типы кристаллической решетки
- •Вещество Типы кристаллической решетки
- •Занятие 19. Химическая связь, валентность и степени окисления элемента
- •6 На занятии проводится тестовый контроль по теме «Химическая связь».
- •Тема 4. Основные закономерности протекания химических реакций
- •Типовые задачи с решениями
- •Занятие 23. Скорость химических реакций
- •Типовые задачи с решениями
- •Занятие 24. Химическое равновесие.
- •Типовые задачи с решениями
- •Тема 5. Растворы. Электролитическая диссоциация Занятие 27. Растворимость веществ
- •Типовые задачи с решениями
- •Занятие 28. Массовая доля растворенного вещества
- •Типовые задачи с решениями
- •Занятие 29. Молярная концентрация растворов. Объемная доля растворенного вещества в растворе.
- •Типовые задачи с решениями
- •Занятие 30. Практическая работа № 1 «Приготовление растворов заданной концентрации»
- •Занятие 31. Теория электролитической диссоциации
- •Типовые упражнения с решениями
- •Занятие 32. Диссоциация воды. Понятие о водородном показателе
- •6 На занятии проводится тестовый контроль по теме «Растворы, растворимость и концентрация веществ в растворе».
- •Типовые задачи с решениями
- •Занятие 33. Гидролиз
- •Типовые задачи с решениями
- •Занятие 34. Реакции обмена в водных растворах электролитов
- •Типовые упражнения с решениями
- •Занятие 35. Практическая работа № 2 «Электролиты. Ионные реакции в растворах»
- •6 На занятии проводится тестовый контроль по теме «Электролитическая диссоциация. Ионные уравнения реакций».
- •Тема 6. Окислительно-восстановительные реакции. Электролиз расплавов и растворов.
- •Типовые упражнения с решениями
- •Занятие 39, 40. Электролиз расплавов и растворов
- •6 На занятии проводится тестовый контроль по теме «овр. Электролиз».
- •Типовые упражнения с решениями
- •Тема 7. Важнейшие классы неорганических соединений.
- •Занятие 41. Оксиды
- •Типовые упражнения с решениями
- •Занятие 42. Кислоты
- •См. Схему стр. 71. Типовые упражнения с решениями
- •Занятие 43. Основания. Амфотерные гидроксиды
- •Типовые упражнения с решениями
- •Занятие 44. Соли
- •Типовые упражнения с решениями
- •Занятие 45. Генетическая связь между классами неорганических соединений
- •Практическая работа № 3 «Классы неорганических соединений»
- •6 На занятии проводится тестовый контроль по теме «Важнейшие классы неорганических соединений».
- •Занятия 47. @Проверочная работа 5. «Важнейшие классы неорганических соединений». Анализ результатов проверочной работы. Коррекция знаний
- •Приложение Метрическая система мер
- •Основные формулы для решения задач
- •Рекомендуемая литература
- •Егоров а.С. Химия: современный курс для подготовки к егэ. Ростов н/д: Феникс, 2011. (2012)– 699 с.
- •Содержание
Занятие 44. Соли
Повторите: определение солей с точки зрения теории электролитической диссоциации.
& Вопросы для самостоятельной подготовки
Классификация солей по составу.
Графические формулы и номенклатура.
Химические свойства солей.
Основные способы получения солей.
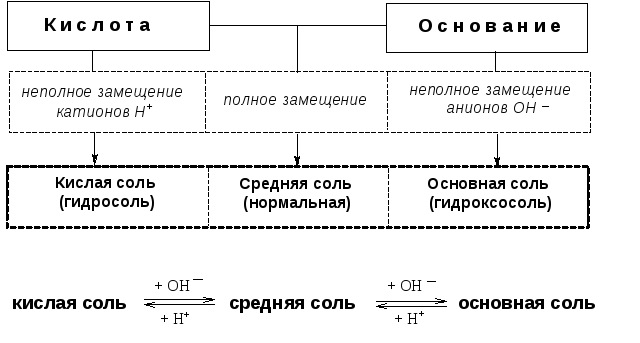
Типовые упражнения с решениями
Задача № 1
Через 500 мл 1М раствора едкого натра пропущено 11,2 л оксида серы (IV) при н.у. Какая соль и в каком количестве образовалась?
Решение:
При взаимодействии SO2 и гидроксида натрия может образоваться две соли: средняя и кислая:
SO2 + NaOH = NaHSO3 (1)
SO2 + 2NaOH = Na2SO3 + H2O (2)
Чтобы установить формулу соли, необходимо знать количественное соотношение оксида и щелочи.
Рассчитываем количества исходных веществ:
n(NaOH) = с(NaOH)V(р-ра) = 10,5 = 0,5 моль;
n(SO2)=
![]() =
=![]() =0,5 моль.
=0,5 моль.
Так
как
![]() =
=![]() =
=![]() ,
следовательно, образовалась соль NaHSO3.
,
следовательно, образовалась соль NaHSO3.
Рассчитаем количество соли:
n(NaHSO3) = n(SO2) = n(NaOH) = 0,5 моль.
Ответ: 0,5 моль NaHSO3.
Упражнения и задачи для самостоятельного решения
Составьте уравнения реакций, не изменяя коэффициенты к исходным веществам: H3PO4+2KOH ; Al(OH)3+1HCl ; Ca(OH)2+2CO2 ; H2SO4+1NaOH ; 2H3PO4+Ca(OH)2 . Назовите полученные продукты.
Смешали 100 мл 20%-ного раствора серной кислоты (пл.=1,14 г/мл) и 400 г 5,2%-ного раствора хлорида бария. Какая масса осадка образуется? (Ответ: 23,3 г)
Какой объем раствора с массовой долей соляной кислоты 30% (пл.=1,15 г/мл) пойдет на взаимодействие с карбонатом кальция массой 250 г, содержащим 20% примесей? (Ответ: 423,19 мл)
Смешали 120 мл 10%-ного раствора соляной кислоты (пл.=1,05 г/мл) и 200 мл 0,5М раствора нитрата серебра. Какая масса осадка образуется? (Ответ: 14,35 г)
Какое количество вещества гидросульфата натрия образуется при смешении 200 г 39,2%-ного раствора серной кислоты и 200 г 8%-ного раствора гидроксида натрия? (Ответ: 0,4 моль)
Напишите формулы всех теоретически возможных солей, отвечающих взаимодействию: а) гидроксида кальция и ортофосфорной кислоты (4 соли); б) гидроксида железа(III) и серной кислоты (4 соли)
48 г оксида железа(III) восстановили до металла нагреванием в токе СО. Образовавшийся после реакции газ пропустили через раствор, полученный действием 36 г металлического кальция на воду. Какая соль образовалась и какова ее масса? (Ответ: 90 г)
Раствор, содержавший 6 г едкого натра, поглотил 2,24 л СО2 (н.у.). Установите массы веществ, находящихся в растворе после поглощения СО2. (Ответ: 4,2 г NaHCO3; 5,3 г Na2CO3)
К раствору, содержащему 5,88 г ортофосфорной кислоты прибавили раствор, содержащий 8,4 г едкого кали. Определите состав осадка, полученного при выпаривании раствора досуха.
(Ответ: 6,3 г К3РО4; 5,22 г К2НРО4)
К 200 г раствора с массовой долей AlCl3 13,35% добавили 400 мл 2М раствора гидроксида натрия. Какие соли и какой массой образовались? (Ответ: 23,6 г; 35,1 г).
Занятие 45. Генетическая связь между классами неорганических соединений

Упражнения и задачи для самостоятельного решения
Осуществите следующие превращения:
а) Na NaH NaOH NaHSO3 Na2SO3 Na2SO4 NaCl
NaNO3 KNO3;
б) Cu CuSO4 Cu(OH)2 CuO Cu(NO3)2 CuOHNO3;
в) Zn ZnCl2 Zn(OH)2 Na2ZnO2
Na2[Zn(OH)4] Zn(NO3)2
г) Mg MgO MgSO4 (MgOH)2SO4 Mg(OH)2 MgCl2
MgCO3.
Приведите все возможные способы получения сульфата меди.
Через 800 мл 0,5М раствора гидроксида бария пропустили 17,92 л оксида серы(IV). Какая соль и какой массой образуется? (Ответ: 119,6 г)
Какая масса раствора с массовой долей соляной кислоты 20% требуется для полного растворения 10 г смеси цинка с оксидом цинка, если выделилось 2,24 л водорода? (Ответ: 52,25 г)
К 25 мл раствора с массовой долей соляной кислоты 10% (=1,047 г/мл) прибавили 30 мл раствора гидроксида натрия с масовой долей щелочи 10% (=1,409 г/мл). Какова реакция среды после окончания реакции?
Продукты полного сгорания 4,48 л сероводорода (н.у.) в избытке кислорода поглощены 57,4 мл 20%-ного раствора гидроксида натрия (=1,22 г/мл). Вычислите массовые доли веществ в полученном растворе и массу осадка, который выделится при обработке этого раствора избытком нитрата кальция.
(Ответ: 6,02% NaHSO3; 21,9% Na2SO3; 18,0 г CaSO3)
48,8 г смеси гидрокарбонатов аммония, натрия и кальция прокалили до постоянной массы. При обработке полученного твердого остатка массой 16,2 г раствором соляной кислоты выделилось 2,24 л газа (н.у.). Определите массы солей в исходной смеси.
(Ответ: 15,8 г; 16,8 г; 16,2 г)
Заполните схему: в пустых клетках укажите продукты реакции.

Занятие 46
