
- •2)Оновные этапы развития фармхимии.Современные проблемы и перспективы.
- •5.Принципы класс-ии лс
- •6. Использование природных соединений в качестве лс
- •7. Получение лс путём химмодификац и полного хим синтеза
- •8. Применение микробиол метод и генной инженер для получ лс
- •10. Стандарты надлежащих практик.
- •11. Система контроля качества лекарственных средств в рб
- •12. Проблема фальсификации лс
- •13. Нормативная документация, регламентирующая качество лс. Гос.Фармакопея. Фармакопейные статьи.
- •14. Международная и национальные фармакопеи
- •15. Стабильность и сроки годности лс
- •16. Факторы окружающей среды, влияющие на стабильность лс
- •17. Типы химических реакций на стабильность приводящих к изменению лв…
- •18. Кинетические закономерности разрушения лс. Способы повышения стабильности
- •21. Фармацевтический анализ как составная часть фарм. Химии и раздел прикладной аналитич. Химии…..
- •22. Виды фармацевтического анализа:……
- •23. Основные принципы фармакопейного анализа…..
- •24. Предпосылки для выбора метода кол. Определения лв….
- •25. Отбор пробы и пробоподготовка при анализе…..
- •26. Особенности анализа многокомпонен. Лф
- •27. Особенности контроля качества лс аптечного изготовления….
- •19. Долгосрочные, ускоренные и стрессовые испытания стабильности лс…
- •20. Требования к контейнерам для хранения и условиям….
- •28.Нормативно-правовые акты регламентирующие контроль качества лс аптечного изготовления
- •29Сравнительная оценка хроматографических,спектрометрических,белковосвязывающих и др методов ,применяемых для определения лв в биологических
- •31.Исследования фармакокинетики лс.Основные фармакокинетические параметры:биодоступность,объем распределения…и т.Д
- •32.Метаболизм лв.Основные фазы метаболизма:несинтетическая(р-ции ок-я,восс-я,гидролиза) и синтетическая(р-ции конъюгации)
- •33.Биоэквивалентные иссследования генерических лс.Понятия терапевтической…и т.Д.
- •34.Особенности аналитического этапа биоэквивалентных исследований генерических лс
- •35.Связь между концентрацией Лс в биологических жидкостях и его действием.Терапевтический мониторинг лс
- •36.Валидация аналитических методик,используемых в фармацевтическом анализе
- •37. Гравиметрия. Кислотно-основное титрование в водных…
- •38. Окислительно-восстановительное титрование: иодометрия, хлориодометрия и т.Д
- •39.Комплексометрическое (комплексонометрия, меркуриметрия) и осадительное (аргентометрия) титрование. Применение
- •40. Атомно-абсорбционная и атомно-эмиссионная спектрометрия. Применение в фарм анализе
- •43. Спектрофотометрия ядерно-магнитного резонанса.
- •44.Флуориметрия. Применение в фарм анализе.
- •45. Спектрометрия комбинационного рассеяния, нефелометрия, турбидиметрия.
- •49.Вольтамперометрия и амперометрическое титрование.
- •48.Кондуктометрия,потенциометрия.
- •51.Тонкослойная хроматография.
- •50.Газовая хроматография
- •52.Жидкостная хроматография
- •53.Эксклюзионная хроматография
- •54Электрофорез
- •56.Термические методы анализа: термогравиметрия, дифференциальный термический анализ, дифферинциальная сканирующая калориметрия.Применение в фармацевтическом анализе.
- •57.Белоксвязывающие методы анализа: иммунохимические и рецепторные. Биологические методы анализа. Применение в фармацевтическом анализе.
- •60.Методы идентификации,исп в фармакопейном анализе. 1 и 2 идентификация. Применение инструментальных методов для идентификации фарм субстанций.
- •61. Общая фармакопейная статья гф рб «Реакции подлинности ( идентификации) на ионы и функциональные группы». Примеры реакций идентификации катионов.
- •62. Общая фармакопейная статья гф рб «Реакции подлинности ( идентификации) на ионы и функциональные группы». Примеры реакций идентификации анионов.
- •63.Общая фармакопейная статья гф рб «Реакции подлинности ( идентификации) на ионы и функциональные группы». Примеры реакций идентификации функциональных групп.
- •64)Определение температуры плавления, затвердевания, каплепадения, темпер пределов перегонки и темп кипения.
- •22 Температура каплепадения
- •65)Определение плотности и вязкости жидкостей. Виды вязкости
- •66)Определение удельного вращения и показателя преломления.
- •67)Потенциометрическое определение pH.
- •68)Природа и характер посторонних в-в в фарм субстанциях. Влияние примесей на качественный и количественный состав лс и его фарм активность. Допустимые и недопустимые примеси.
- •69)Общие и частные методы обнаружения примесей. Общая фарм статья гф рб:Испытания на предельное содержание примесей.
- •70)Определение окраски жидкостей, прозрачности и степени мутности жидкостей.
- •71)Определение летучих в-в и воды, потери в массе при высушивании, общей золы и сульфатной золы. Химический метод определения воды: акваметрия (Метод Карла Фишера)
- •72)Идентификация остаточных растворителей и контроль их количества. Определение микробиологической чистоты фарм субстанций.
- •72. Микробиологическая чистота субстанций и вспомогательных
- •73.Фарм. Контроль качества воды очищенной и для иньекций.
38. Окислительно-восстановительное титрование: иодометрия, хлориодометрия и т.Д
( Беликов) Иодометрия – метод, основанный на окислит св-вах иода и восстановит св-вах йодид-ионов: I2 + 2e- = 2I- 2I- - 2e- = I2
Титрант – р-р йода (индикатор – крахмал)
Исп также обратное йодометрич титрование. При этом избыт йода титруют 0,1 М р-ром тиосульфата натрия:
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
Восстановит св-ва йодида калия исп для колич опред в-в, обладающих окислит св-вами. Выделившееся эквив количество йода оттитровывают тиосульфата натрия.
Хлориодометрия – исп в качестве титранта более устойчивый йодмонохлорид. Избыток титранта устанавливают йодометрически:
ICl + KI = I2 + KCl
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
Йодатометрия основана на определении органич соед йодатом кадия. Изб титрантаустанавливают йидометрически:
KIO3 + 5KI + 6 HCl = 3I2 + 6KCl + 3H2O
Перманганатометрия основана на окислит св-вах титранта – KmnO4 в кислой среде: MnO4- + 8H+ + 5e- = Mn2+ + 4H2O
Индикатор – сам титрант (фиол окр), а при обратн титровании изб титранта устанавливают йодометрич методом.
Цериметрия основана на исп окислит св-вах титранта – соли церия (IV), который в кислой среде восстанавливается до церия (III):
Ce4+ + е- = Се3+
Индикаторы: дифениламин, о-фенантролин, а при обрант изб титранта устанавливаю йодометрич методом:
2Се(SO4)2 + 2KI = I2 + Ce2(SO4)3 + K2SO4
(ЖАК) Нитритометрическое титрование - титриметрический метод анализа, основанный на применении в качестве титранта NaNO2.
В фармацевтическом анализе данное титрование используется для количественного определения первичных и вторичных ароматических аминов, а также гидразидов. В основе определения первичных ароматических аминов лежит реакция диазотирования, вторичных аминов - образование N-нитрозопроизводных, гидразидов – образование азидов.

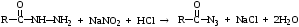
Нитритометрическое титрование является фармакопейным методом определения первичных ароматических аминов, например, сульфаниламидов или производных п-аминобензойной кислоты (анестезина, новокаина). Нитритометрическому определению может предшествовать гидролиз определяемого вещества (парацетамол) или восстановление нитрогруппы (левомицетин). Кроме первичных ароматических аминов нитритометрически могут быть количественно определены вторичные ароматические амины (например, местный анестетик тетракаин, или дикаин) и гидразиды (например, изониазид).
Дихроматометрическое титрование - титриметрический метод анализа, основанный на применении в качестве титранта K2Cr2O7.
 E0
= +1,33 В
E0
= +1,33 В
Стандартный раствор K2Cr2O7 является первичным. Он устойчив при хранении. В отличие от KMnO4 дихромат не восстанавливается следами органических веществ и хлорид-ионов, содержащихся в воде. Для обнаружения конечной точки титрования обычно используют окислительно-восстановительные индикаторы: дифениламин, ферроин и др.
Дихроматометрическое титрование применяют для определения восстановителей, некоторых окислителей, а также ионов, образующих малорастворимые в воде хроматы или дихроматы. Как и перманганатометрическое титрование дихроматометрия используется, главным образом, для определения неорганических веществ и сравнительно редко используется в фармацевтическом анализе.
Прямое дихроматометрическое титрование заключается в том, что раствор определяемого восстановителя подкисляют серной кислотой и титруют стандартным раствором K2Cr2O7, например:
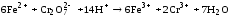
Если реакция окисления протекает медленно, используют обратное титрование. Дихроматометрическое титрование может быть использовано для определения некоторых необратимо восстанавливающихся окислителей, например, нитратов или хлоратов. К раствору, содержащему определяемое вещество, добавляется избыток стандартного раствора Fe2+. После проведения реакции оставшееся количество Fe2+ титруют стандартным раствором K2Cr2O7.
Дихроматометрическое титрование используется также как осадительное титрование для определения веществ, образующих малорастворимые в воде хроматы или дихроматы. К раствору, содержащему определяемый катион, добавляют избыток стандартного раствора дихромата калия. Выпавший осадок отфильтровывают, а в фильтрате определяют оставшееся количество K2Cr2O7 путём титрования стандартным раствором Fe2+ или иодометрически. Такой вариант титрования используется, например, для определения метиленового синего
