
- •Федеральное агентство по рыболовству
- •Принципы молекулярной логики живого
- •Глава 1 химический состав организмов
- •Важнейшие классы органических соединений
- •Структура, свойства и биологические функции воды
- •Содержание основных катионов и анионов внутри клетки и во внеклеточных жидкостях организма человека (по а.Е. Строеву)
- •Вопросы для самоконтроля
- •Глава 2 белки
- •Протеиногенные аминокислоты
- •Классификация протеиногенных аминокислот
- •Химические свойства аминокислот
- •Сложные белки
- •Вопросы и задания для самоконтроля к главе 2 «белки»
- •Глава 3 нуклеиновые кислоты
- •Функции мононуклеотидов
- •Вопросы для самоконтроля к главе 3
- •Глава 4 Биосинтез белка
- •Вопросы для самоконтроля к главе 4 «Биосинтез белка»
- •Глава 5 Биологический катализ. Ферменты
- •Строение фермента
- •Классификация ферментов.
- •Свойства ферментов
- •Регуляция активности ферментов
- •Вопросы для самоконтроля к главе 5 «Биологический катализ. Ферменты»
- •Глава 6 витамины
- •Витамины, их коферментные формы и катализируемые реакции
- •Вопросы для самоконтроля к главе 6 «Витамины»
- •Глава 7 Углеводы Классификация углеводов, строение, свойства
- •Вопросы для самоконтроля к главе 7 «Углеводы»
- •Глава 8 Обмен веществ и энергии. Обмен углеводов
- •Обмен углеводов Переваривание и всасывание углеводов
- •Дихотомический путь распада глюкозы
- •Цикл Кребса (цтк)
- •Дыхательная цепь (электронтранспортная цепь)
- •Прямой путь окисления глюкозы (пентозофосфатный цикл).
- •Вопросы для самоконтроля к главе 8 «Обмен веществ и энергии. Обмен углеводов»
- •Глава 9 Липиды
- •Некоторые природные жирные кислоты
- •Вопросы для самоконтроля к главе 9 «Липиды»
- •Глава 10 обмен жиров Внешний обмен жиров
- •Метаболизм глицерина
- •Окисление жирных кислот
- •Синтез жиров
- •Вопросы для самоконтроля к главе 10 «Обмен жиров»
- •Глава 11 обмен белков
- •Распад белков в тканях
- •Вопросы для самоконтроля к главе 11 «Обмен белков»
- •Глава 12 гормоны. Взаимосвязь процессов обмена веществ
- •Пептидные гормоны
- •Гормоны – производные аминокислот (прочие гормоны)
- •Фитогормоны
- •Регуляция секреции гормонов
- •Взаимосвязь процессов обмена веществ
- •Вопросы для самоконтроля к главе 12 «Гормоны. Взаимосвязь процессов обмена веществ»
- •Практикум
- •Техника безопасности работы в биохимической лаборатории
- •Рабочий журнал
- •Лабораторная работа № 1 цветные реакции на белки
- •Вопросы к лабораторной работе «Цветные реакции на белки»
- •Лабораторная работа № 2 реакции осаждения белков
- •Вопросы к лабораторной работе «Реакции осаждения белков»
- •Лабораторная работа № 3 нуклеопротеиды
- •Дифениламиновая проба (реакция Дише)
- •Проба Троммера
- •Реакция Толленса
- •Вопросы к лабораторной работе «Качественные реакции на отдельные ферменты»
- •Лабораторная работа № 5 количественное определение аскорбиновой кислоты
- •Вопросы к лабораторной работе «Количественное определение аскорбиновой кислоты»
- •Лабораторная работа № 6 Количественное определение углеводов
- •Содержание глюкозы в 0,1 мл вытяжки, в мг
- •Вопросы к лабораторной работе «Количественное определение углеводов»
- •Лабораторная работа №7 жировые константы Определение йодного числа жира
- •Определение кислотного числа жира
- •Вопросы к лабораторной работе «Жировые константы»
- •Рекомендуемая литература
Вопросы для самоконтроля к главе 4 «Биосинтез белка»
Дайте определение понятиям «триплет», «кодон», «антикодон».
Где в клетке синтезируется белок?
Что такое транскрипция?
Что такое трансляция?
Что такое ген?
Что такое оперон?

Глава 5 Биологический катализ. Ферменты
Все химические процессы в клетке ускоряются специальными биологическими катализаторами, которые называются ферментами или энзимами. Таким образом, ферменты – это вещества, которые повышают скорость химических реакций, протекающих в живых организмах, при этом они не расходуются. В настоящее время известно более 3200 ферментов.
Ферменты имеют белковую природу (за исключением некоторых молекул РНК, способных к автокатализу и называемых «рибозимами»), им присущи все свойства белков.
Ферменты, выполняя функцию катализатора, подчиняются общим законам катализа и обладают всеми свойствами неорганических катализаторов:
а) повышают скорость реакции, понижая энергию активации (Рис.17).
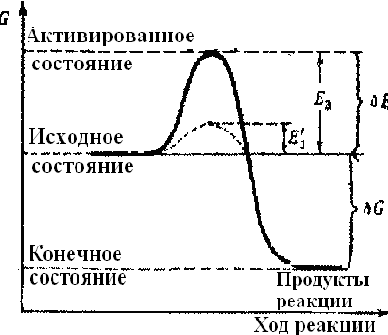
Рис.17. Диаграмма изменения энергии реакции без фермента Еа (сплошная линия) и с ферментом Еа` (пунктирная линия)
Энергия активации - это дополнительное количество энергии, необходимое молекулам вещества, чтобы они вступили в реакцию. Снижение энергии активации связано с многостадийностью протекания ферментативных реакций, которые идут не в один этап, а ступенчато, через несколько промежуточных реакций. Активационный барьер реакции разбивается при этом на несколько более низких барьеров каждой промежуточной реакции, которые легче преодолеть, чем один большой активационный барьер;
б) катализируют только энергетически возможные реакции, т.е ферменты ускоряют реакции, которые могут протекать и без катализатора, но с малой скоростью;
в) увеличивая скорость реакции, они не расходуются в процессе катализа и не претерпевают необратимых изменений, выходя из реакции в первоначальном виде;
г) не смещают химического равновесия, а лишь ускоряют его достижение, т.к. в равной степени ускоряют как прямую, так и обратную реакции.
От неорганических катализаторов ферменты отличаются:
а) высокой эффективностью действия. Скорость ферментативных реакций в 106-1012 раз выше, чем соответствующих реакций, катализируемых неорганическими катализаторами;
б) действуют в мягких условиях клетки: физиологическом значении рН, температуре тела и постоянном атмосферном давлении, тогда как химические катализаторы действуют, как правило, в жестких условиях;
в) обладают высокой специфичностью действия (избирательностью) т.е. способностью взаимодействовать лишь с одним или несколькими субстратами
г) обладают способностью к регуляции.
Ферменты, как и белки, делятся на простые (представлены только белковой молекулой) и сложные, которые помимо белковой части, называемой апоферментом, содержат еще небелковую часть (кофактор). Если кофактор прочно связан с апоферментом, он называется простетической частью, при непрочном связывании – коферментом. Кофермент может существовать самостоятельно, не проявляя заметной каталитической активности, и рассматривается как второй субстрат.
Механизм действия ферментов.
