
- •Федеральное агентство по рыболовству
- •Принципы молекулярной логики живого
- •Глава 1 химический состав организмов
- •Важнейшие классы органических соединений
- •Структура, свойства и биологические функции воды
- •Содержание основных катионов и анионов внутри клетки и во внеклеточных жидкостях организма человека (по а.Е. Строеву)
- •Вопросы для самоконтроля
- •Глава 2 белки
- •Протеиногенные аминокислоты
- •Классификация протеиногенных аминокислот
- •Химические свойства аминокислот
- •Сложные белки
- •Вопросы и задания для самоконтроля к главе 2 «белки»
- •Глава 3 нуклеиновые кислоты
- •Функции мононуклеотидов
- •Вопросы для самоконтроля к главе 3
- •Глава 4 Биосинтез белка
- •Вопросы для самоконтроля к главе 4 «Биосинтез белка»
- •Глава 5 Биологический катализ. Ферменты
- •Строение фермента
- •Классификация ферментов.
- •Свойства ферментов
- •Регуляция активности ферментов
- •Вопросы для самоконтроля к главе 5 «Биологический катализ. Ферменты»
- •Глава 6 витамины
- •Витамины, их коферментные формы и катализируемые реакции
- •Вопросы для самоконтроля к главе 6 «Витамины»
- •Глава 7 Углеводы Классификация углеводов, строение, свойства
- •Вопросы для самоконтроля к главе 7 «Углеводы»
- •Глава 8 Обмен веществ и энергии. Обмен углеводов
- •Обмен углеводов Переваривание и всасывание углеводов
- •Дихотомический путь распада глюкозы
- •Цикл Кребса (цтк)
- •Дыхательная цепь (электронтранспортная цепь)
- •Прямой путь окисления глюкозы (пентозофосфатный цикл).
- •Вопросы для самоконтроля к главе 8 «Обмен веществ и энергии. Обмен углеводов»
- •Глава 9 Липиды
- •Некоторые природные жирные кислоты
- •Вопросы для самоконтроля к главе 9 «Липиды»
- •Глава 10 обмен жиров Внешний обмен жиров
- •Метаболизм глицерина
- •Окисление жирных кислот
- •Синтез жиров
- •Вопросы для самоконтроля к главе 10 «Обмен жиров»
- •Глава 11 обмен белков
- •Распад белков в тканях
- •Вопросы для самоконтроля к главе 11 «Обмен белков»
- •Глава 12 гормоны. Взаимосвязь процессов обмена веществ
- •Пептидные гормоны
- •Гормоны – производные аминокислот (прочие гормоны)
- •Фитогормоны
- •Регуляция секреции гормонов
- •Взаимосвязь процессов обмена веществ
- •Вопросы для самоконтроля к главе 12 «Гормоны. Взаимосвязь процессов обмена веществ»
- •Практикум
- •Техника безопасности работы в биохимической лаборатории
- •Рабочий журнал
- •Лабораторная работа № 1 цветные реакции на белки
- •Вопросы к лабораторной работе «Цветные реакции на белки»
- •Лабораторная работа № 2 реакции осаждения белков
- •Вопросы к лабораторной работе «Реакции осаждения белков»
- •Лабораторная работа № 3 нуклеопротеиды
- •Дифениламиновая проба (реакция Дише)
- •Проба Троммера
- •Реакция Толленса
- •Вопросы к лабораторной работе «Качественные реакции на отдельные ферменты»
- •Лабораторная работа № 5 количественное определение аскорбиновой кислоты
- •Вопросы к лабораторной работе «Количественное определение аскорбиновой кислоты»
- •Лабораторная работа № 6 Количественное определение углеводов
- •Содержание глюкозы в 0,1 мл вытяжки, в мг
- •Вопросы к лабораторной работе «Количественное определение углеводов»
- •Лабораторная работа №7 жировые константы Определение йодного числа жира
- •Определение кислотного числа жира
- •Вопросы к лабораторной работе «Жировые константы»
- •Рекомендуемая литература
Строение фермента
Все ферменты представляют собой глобулярные белки, намного превосходящие по размерам субстрат. На рисунке 18 показаны относительные размеры молекулы фермента (диаметр 7 нм, молекулярная масса 100000) и типичной молекулы субстрата (молекулярная масса 250, длина 0,8 нм). Для сравнения показана молекула воды. На поверхности фермента находится активный центр, который занимает лишь небольшую часть поверхности фермента.
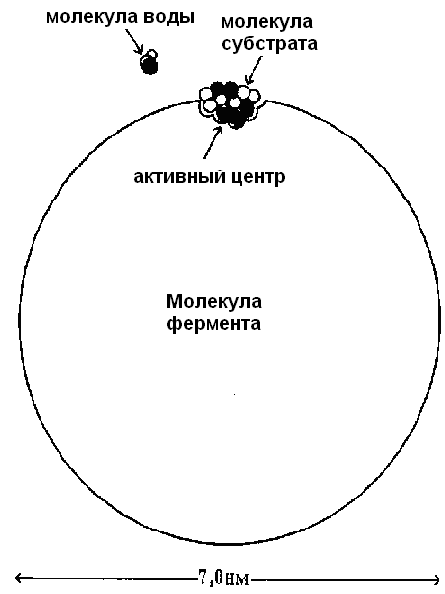
Рис. 18. Относительные размеры молекулы фермента и субстрата
Условно активный центр можно разделить на две части — связывающий центр и каталитический центр. Связывающий центр (субстратный центр) выполняет функцию специфического связывания субстрата и его оптимальной ориентации по отношению к катализирующим группам. В простом ферменте, который представляет собой простой белок, каталитический центр формируется боковыми радикалами аминокислотных остатков белка. Так, в активном центре простого фермента ацетилхолинэстеразы, ускоряющей реакцию гидролиза ацетилхолина, находятся радикалы глутаминовой кислоты, тирозина, гистидина и серина.
Выделяют несколько этапов ферментативной реакции:
а) этап сближения и ориентации субстрата относительно активного центра. Субстраты в активном центре располагаются так, чтобы участвующие в реакции функциональные группы находились в непосредственной близости друг от друга;
б) образование ферментсубстратного комплекса ES в результате
индуцированного соответствия между ферментом и субстратом;
в) деформация субстрата и образование нестабильного комплекса
фермент-продукт [EP]. Это наиболее медленный этап. Длительность этапа зависит от энергии активации реакции. Происходит разрыв связей в молекуле субстрата, образование новых связей и формирование продукта;
г) распад комплекса EP с высвобождением из активного центра фермента продуктов и фермента.
E+S→ ES → ES* → EP → E+P
Решающее значение в реакции ферментативного катализа имеет образование нестойкого промежуточного продукта, соответствующего переходному состоянию – ES*, который превращается в нестабильный переходный комплекс ЕР и мгновенно распадается на свободный фермент и продукт реакции. При связывании субстрата с активным центром и активный центр и субстрат претерпевают конформационные изменения.
Классификация ферментов.
По типу катализируемой реакции все ферменты делятся на шесть классов. Каждый класс подразделяется на подклассы, подкласс — на подподклассы. В пределах подподкласса каждый фермент имеет свой порядковый номер. Все ферменты включены в «Каталог ферментов» под своим классификационным номером (КФ), состоящим из четырех цифр. Первая цифра указывает на принадлежность к одному из шести главных классов. Следующие две определяют подкласс и подподкласс, а последняя цифра — номер фермента в данном подподклассе.
1.Оксидоредуктазы. Катализируют окислительно-восстановительные реакции. При окислении может происходить либо отнятие водорода от окисляемого вещества, либо присоединение кислорода к окисляемому веществу. В зависимости от способа окисления различают следующие подклассы оксидоредуктаз:
а) Дегидрогеназы катализируют реакции, при которых происходит отнятие водорода от окисляемого вещества. К данному подклассу относится, например, малатдегидрогеназа, ускоряющая реакцию окисления яблочной кислоты до щавелевоуксусной (ЩУК):

В качестве небелковой части этот фермент содержит систему НАД, которая выступает в качестве промежуточного акцептора электронов.
б) Оксидазы переносят Н или электрон непосредственно на кислород. К оксидазам относятся, например, такие ферменты, как каталаза, пероксидаза.
В) Оксигеназы катализируют включение кислорода в окисляемое вещество. Например, к оксигеназам относится фермент фенилаланингидроксилаза:

Характерная особенность оксидоредуктаз – способность образовывать цепи окислительно-восстановительных реакций, в которых осуществляется перенос Н или е- от первичного субстрата к конечному акцептору – кислороду с образованием воды, примером является дыхательная цепь.
2. Трансферазы. Катализируют реакции переноса группировок с одного соединения на другое. 3. Гидролазы. Ускоряют гидролитическое расщепление веществ. 4. Лиазы. Катализируют реакции негидролитического расщепления с образованием двойных связей или реакции присоединения по двойным связям. 5. Изомеразы. Катализируют реакции изомерации соединений. 6. Лигазы (синтетазы). Ускоряют реакции синтеза с использованием энергии макроэргических соединений.
Всложных ферментах катализ осуществляет небелковая часть - кофактор, белковая часть обеспечивает связывание субстрата, специфичность действия фермента.
