
- •Федеральное агентство по рыболовству
- •Принципы молекулярной логики живого
- •Глава 1 химический состав организмов
- •Важнейшие классы органических соединений
- •Структура, свойства и биологические функции воды
- •Содержание основных катионов и анионов внутри клетки и во внеклеточных жидкостях организма человека (по а.Е. Строеву)
- •Вопросы для самоконтроля
- •Глава 2 белки
- •Протеиногенные аминокислоты
- •Классификация протеиногенных аминокислот
- •Химические свойства аминокислот
- •Сложные белки
- •Вопросы и задания для самоконтроля к главе 2 «белки»
- •Глава 3 нуклеиновые кислоты
- •Функции мононуклеотидов
- •Вопросы для самоконтроля к главе 3
- •Глава 4 Биосинтез белка
- •Вопросы для самоконтроля к главе 4 «Биосинтез белка»
- •Глава 5 Биологический катализ. Ферменты
- •Строение фермента
- •Классификация ферментов.
- •Свойства ферментов
- •Регуляция активности ферментов
- •Вопросы для самоконтроля к главе 5 «Биологический катализ. Ферменты»
- •Глава 6 витамины
- •Витамины, их коферментные формы и катализируемые реакции
- •Вопросы для самоконтроля к главе 6 «Витамины»
- •Глава 7 Углеводы Классификация углеводов, строение, свойства
- •Вопросы для самоконтроля к главе 7 «Углеводы»
- •Глава 8 Обмен веществ и энергии. Обмен углеводов
- •Обмен углеводов Переваривание и всасывание углеводов
- •Дихотомический путь распада глюкозы
- •Цикл Кребса (цтк)
- •Дыхательная цепь (электронтранспортная цепь)
- •Прямой путь окисления глюкозы (пентозофосфатный цикл).
- •Вопросы для самоконтроля к главе 8 «Обмен веществ и энергии. Обмен углеводов»
- •Глава 9 Липиды
- •Некоторые природные жирные кислоты
- •Вопросы для самоконтроля к главе 9 «Липиды»
- •Глава 10 обмен жиров Внешний обмен жиров
- •Метаболизм глицерина
- •Окисление жирных кислот
- •Синтез жиров
- •Вопросы для самоконтроля к главе 10 «Обмен жиров»
- •Глава 11 обмен белков
- •Распад белков в тканях
- •Вопросы для самоконтроля к главе 11 «Обмен белков»
- •Глава 12 гормоны. Взаимосвязь процессов обмена веществ
- •Пептидные гормоны
- •Гормоны – производные аминокислот (прочие гормоны)
- •Фитогормоны
- •Регуляция секреции гормонов
- •Взаимосвязь процессов обмена веществ
- •Вопросы для самоконтроля к главе 12 «Гормоны. Взаимосвязь процессов обмена веществ»
- •Практикум
- •Техника безопасности работы в биохимической лаборатории
- •Рабочий журнал
- •Лабораторная работа № 1 цветные реакции на белки
- •Вопросы к лабораторной работе «Цветные реакции на белки»
- •Лабораторная работа № 2 реакции осаждения белков
- •Вопросы к лабораторной работе «Реакции осаждения белков»
- •Лабораторная работа № 3 нуклеопротеиды
- •Дифениламиновая проба (реакция Дише)
- •Проба Троммера
- •Реакция Толленса
- •Вопросы к лабораторной работе «Качественные реакции на отдельные ферменты»
- •Лабораторная работа № 5 количественное определение аскорбиновой кислоты
- •Вопросы к лабораторной работе «Количественное определение аскорбиновой кислоты»
- •Лабораторная работа № 6 Количественное определение углеводов
- •Содержание глюкозы в 0,1 мл вытяжки, в мг
- •Вопросы к лабораторной работе «Количественное определение углеводов»
- •Лабораторная работа №7 жировые константы Определение йодного числа жира
- •Определение кислотного числа жира
- •Вопросы к лабораторной работе «Жировые константы»
- •Рекомендуемая литература
Рабочий журнал
Все наблюдения и выводы по экспериментальной работе следует заносить в рабочий журнал, отражающий всю работу студента. На обложке или первой странице журнала должны быть написаны фамилия студента, его инициалы, номер группы и название практикума. Записи в журнале производят только ручкой, лаконично, аккуратно, непосредственно после проведения опыта. Запись должна содержать:
1. Дату выполнения работы.
2. Название темы и название опыта.
3. Последовательность проведения операций опыта
4. Ход работы.
5. Рисунок или схему используемого прибора.
6. Наблюдения (изменение окраски веществ, выделение и характер осадка)
.7.. Уравнения происходящих в опытах реакций
8. Расчеты, проводимые при выполнении работы.
9. Ответы на поставленные в занятии вопросы.
10. Выводы.
Лабораторная работа № 1 цветные реакции на белки
Присутствие белка можно обнаружить рядом ц в е т н ы х р е а к ц и й. При взаимодействии белка с отдельными химическими веществами возникают окрашенные продукты реакции. Образование их обусловлено наличием в молекуле белка той или иной аминокислоты или химической группировки. Значение цветных реакций состоит в том, что они дают возможность установить белковую природу вещества и доказать присутствие некоторых аминокислот в различных природных белках. Некоторые из цветных реакций широко используются в биохимической практике для изучения структуры и аминокислотного состава белков, их количественного определения.
Различают универсальные цветные реакции, которые дают все белки, независимо от их аминокислотного состава – биуретовая и нингидриновая реакция. Остальные цветные реакции идут за счет радикалов аминокислот.
Техника безопасности
1. Категорически запрещается отмеривать концентрированные кислоты и щелочи обыкновенными пипетками. Для отмеривания реактивов использовать мерные пробирки, цилиндры.
2. Будьте внимательны при наливании концентрированных кислот и щелочей!
3. В процессе нагревания постоянно перемешивайте жидкость, не допускайте выброса ее из пробирки.
4. Соблюдайте правила пожарной безопасности.
Для качественного определения белков в растительных продуктах вначале готовят водную вытяжку. К одной части муки, помещенной в колбу, добавляют четыре части дистиллированной воды, хорошо взбалтывают и оставляют на некоторое время (желательно на 18-20ч) в прохладном месте. Смесь перемешивают и фильтруют вначале через 4 слоя марли или через вату, а затем – через складчатый бумажный фильтр.
Яичный белок представляет собой смесь нескольких белков. Примерно 70% яичного белка составляет альбумин, который легко отделяется от глобулинов. При десятикратном разведении яичного белка дистиллированной водой глобулины выпадают в осадок, а альбумин остается в растворе.
Чтобы отделить белок от желтка, осторожно проделывают отверстие в скорлупе яйца с двух концов и выливают белок в стакан емкостью 500 мл, затем в стакан добавляют 250 мл дистиллированной воды и содержимое перемешивают стеклянной палочкой с резиновым наконечником.
БИУРЕТОВАЯ РЕАКЦИЯ (ПИОТРОВСКОГО).
При добавлении к щелочному раствору белка раствора сернокислой меди жидкость приобретает красно-фиолетовое или сине-фиолетовое окрашивание. Реакция обусловлена присутствием в белке пептидных связей, которые в щелочной среде присутствуют в лактимной таутомерной форме:
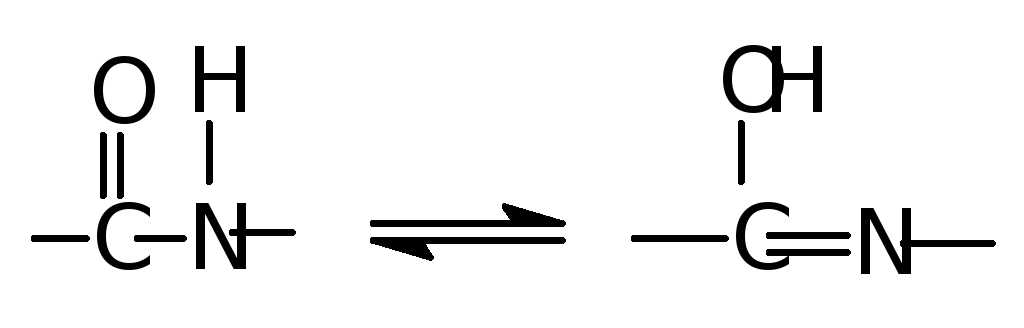
лактамная лактимная
которая с ионами меди образует окрашенный биуретовый комплекс.
В избытке щелочи ОН-группы диссоциируют, в результате чего на кислороде появляется отрицательный заряд, наблюдается электростатическое взаимодействие с ионом меди, возникает солеобразная связь. Кроме того, ион меди образует дополнительные координационные связи с атомами азота за счет использования их неподеленных электронных пар. Схематично реакция может быть представлена в следующем виде:
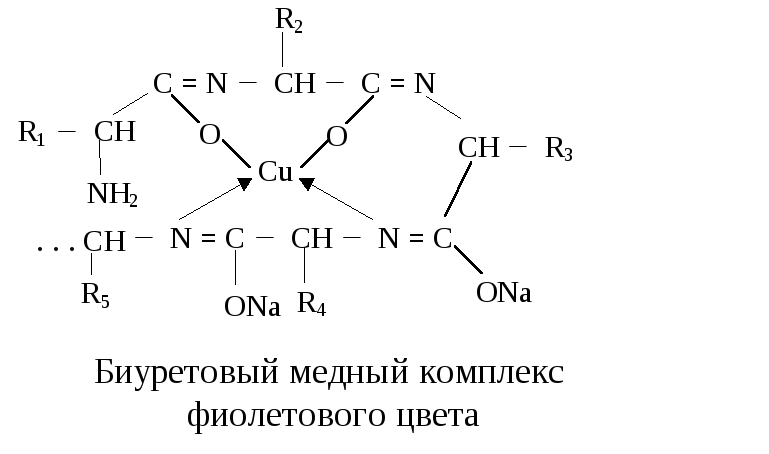
Окраска биуретового комплекса зависит от количества медной соли в растворе и от структуры вещества, с которым координирован ион меди.
Продукты распада белка – пептоны и полипептиды дают биуретовую реакцию с красным оттенком.
Реактивы: CuSO4 - 1% р-р.
NaOH - 10% р-р.
белок куриного яйца,
растительные белки
Ход работы. В 2 пробирки наливают: в одну – 5 капель раствора белка, 5 капель 10% раствора едкого натра и 1 каплю 1% раствора сернокислой меди, в другую –вместо 10% раствора едкого натра наливаете 5 капель дистиллированной воды.
Что наблюдаете? Дайте объяснение.
При малой концентрации белка в растворе биуретовую реакцию производят следующим образом. В пробирку наливают 20 капель 10% раствора едкого натра, добавляют 1-2 капли 1% раствора сернокислой меди и перемешивают.
Затем набирают в пипетку разбавленный раствор белка и осторожно спускают его по стенке пробирки так, чтобы он наслаивался сверху и не смешивался со щелочным раствором сернокислой меди.
На границе двух слоев жидкости образуется фиолетовое кольцо.
НИНГИДРИНОВАЯ РЕАКЦИЯ НА -АМИНОКИСЛОТЫ.
Раствор белка при нагревании с разбавленным раствором нингидрина окрашивается в синий цвет.
Реакция обусловлена наличием в белке остатков -аминокислот. При взаимодействии с нингидрином -аминокислоты окисляются и распадаются с образованием аммиака, альдегида и угольной кислоты. Продукт восстановления нингидрина конденсируется с исходным нингидрином и аммиаком. В результате образуется продукт синего цвета. Уравнения протекающих реакций могут быть представлена в следующем виде:
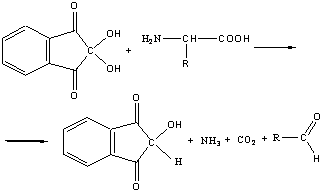
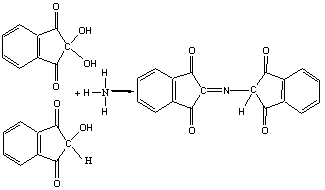
Ход работы. В 3 пробирки наливают: в одну –5 капель 1% раствора яичного белка, в другую -5 капель дистиллированной воды и добавляют около 0,1 г пшеничной муки, в третью-5 капель 0,1% раствора глицина. В каждую пробирку наливают по 2-3 капли 0,1% раствора нингидрина и кипятят. Через 1-2 минуты появляется розовое, красное, а затем синее окрашивание. При стоянии интенсивность окраски увеличивается.
КСАНТОПРОТЕИНОВАЯ РЕАКЦИЯ НА ЦИКЛИЧЕСКИЕ АМИНОКИСЛОТЫ
При нагревании растворов большинства белков с концентрированной азотной кислотой жидкость окрашивается в лимонно-желтый цвет, переходящий при подщелачивании в оранжевый.
Реакция обусловлена присутствием в белке циклических аминокислот-фенилаланина, тирозина и триптофана, которые при взаимодействии с концентрированной азотной кислотой образуют нитропроизводные желтого цвета (реакция нитрования).
Последние при добавлении щелочи превращаются в соли хиноидной структуры, окрашенные в оранжевый цвет.


Белки, в которых циклические аминокислоты отсутствуют, не дают ксантопротеиновой реакции. Помимо белков данную реакцию дают многие более простые ароматические соединения, например фенол.
Аналогично протекает реакция нитрования триптофана и фенилаланина (последний нитруется труднее).
Реактивы: раствор яичного белка,
раствор растительного белка,
раствор желатины,
р-р HNO3 конц.
30% р-р NaOH
Ход работы. В 3 пробирки наливают: в первую-5 капель 1% раствора яичного белка, во вторую-5 капель раствора растительного белка, в третью-5 капель 1% раствора желатины. Во все пробирки добавляют по 2-3 капли концентрированной азотной кислоты и нагревают. В первой и второй пробирках жидкость окрашивается в лимонно-желтый цвет, в третьей получается едва заметное бледно-желтое окрашивание. После охлаждения в каждую пробирку добавляют по 10 капель концентрированного раствора аммиака или 30% раствора едкого натра. Окраска жидкости переходит в оранжевую.
РЕАКЦИЯ МИЛЛОНА (НА ТИРОЗИН).
При нагревании растворов большинства белков с реактивом Миллона (смесь азотнокислых и азотистокислых солей закиси ртути, растворенных в концентрированной азотной кислоте) образуется осадок белка, окрашенный в красный цвет. Реакция обусловлена присутствием в белке циклической аминокислоты тирозина, которая при взаимодействии с реактивом Миллона дает ртутную соль своего нитропроизводного, окрашенную в красный цвет. Белки, не содержащие тирозина (желатина, клупеин, сальмин и др.), не дают эту цветную реакцию.. Если реакцию Миллона производят с раствором тирозина или с растворами полипептидов, содержащих тирозин, то осадок не образуется, но жидкость равномерно окрашивается в красный цвет. Эту реакцию широко используют для количественного определения тирозина в гидролизатах белка и для определения некоторых производных тирозина, дающих эту реакцию. Реакция может быть изображена в следующем виде:
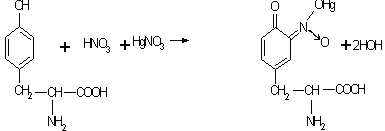
Тирозин Ртутная соль нитротирозина
Следует избегать прибавления избытка реактива Миллона, так как он содержит азотную кислоту, которая может дать желтое окрашивание (ксантопротеиновая реакция), которое будет маскировать реакцию Миллона.
Реакция Миллона не является строго специфичной для тирозина. Ее дают фенолы, полифенолы, а также алкалоиды, имеющие фенольную группировку. Однако все эти вещества отсутствуют в молекуле белка.
Реактивы: раствор яичного белка,
раствор растительного белка,
раствор желатины,
реактив Миллона
Ход работы. В 3 пробирки наливают: в первую-5 капель 1% раствора яичного белка, во вторую-5 капель раствора растительного белка, в третью-5 капель 1% раствора желатины. Во все пробирки прибавляют по 1-2 капли реактива Миллона и осторожно нагревают. В первых двух пробирках осадок белка приобретает красное окрашивание, в пробе с желатиной осадок растворяется и жидкость остается бесцветной.
РЕАКЦИЯ НА АРГИНИН (САКАГУЧИ).
При добавлении к раствору белка щелочи, гипобромита и - нафтола жидкость окрашивается в красный цвет.
Реакция обусловлена присутствием в белке аминокислоты аргинина, имеющей в своем составе гуанидиновую группировку. В результате реакции образуется сложное соединение красного цвета, представляющее собой продукт конденсации окисленного аргинина с -нафтолом. Гипобромит играет роль окислителя гуанидиновой группировки данной аминокислоты. Окисленный аргинин реагирует с -нафтолом , при этом образуется продукт конденсации красного цвета.

Реактивы: раствор яичного белка,
раствор растительного белка
NaOH - 15% р-р, - нафтол,
р-р гипобромита натрия
Ход работы. В 2 пробирки наливают: в первую-5 капель 1% раствора яичного белка, во вторую-5 капель раствора растительного белка и добавляют в каждую по 5 капель 10% раствора едкого натра, по 3 капли 0,1% спиртового раствора -нафтола и по каплям (1-3-5) 2% раствора гипобромита натрия (избыток гипобромита мешает реакции). Жидкость в обеих пробирках окрашивается в красный цвет.
РЕАКЦИЯ ФОЛЯ (С УКСУСНОКИСЛЫМ СВИНЦОМ)
При добавлении к раствору белка крепкой едкой щелочи, уксуснокислого свинца и последующем кипячении раствор начинает темнеть. Реакция обусловлена присутствием в белке серосодержащих аминокислот, в молекулах которых сера связана относительно слабо (это цистеин и цистин) и легко отщепляется при щелочном гидролизе в виде сероводорода, который реагирует со щелочью, образуя сульфиды натрия или калия.
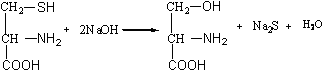
Цистеин Серин
Сульфиды реагируют с плюмбитом натрия, который образуется при взаимодействии ацетата свинца со щелочью
(CH3COO)2Pb + 2 NaOH → Na2PbO2 + 2CH3COOH
Сернистый натрий при взаимодействии с плюмбитом натрия образует черный осадок сернистого свинца:
Na2S + Na2PbO2 + 2H2O → PbS + 4 NaOH
Ход работы. К 1 мл 1%-го раствора яичного белка или кусочку шерстяной нити добавляют 1 мл 30%-й щелочи и 3-4 капли 5%-го раствора ацетата свинца. При интенсивном кипячении жидкость окрашивается в бурый или черный цвет. Реакцию Фоля проделывают с 1%-м раствором желатина, сравнивают полученные результаты и делают вывод.
ОТКРЫТИЕ АМИНОКИСЛОТ В ПОТЕ
Пот, выделяемый потовыми железами кожи, содержит кроме воды (98-99%) ряд неорганических (хлорид натрия, хлорид калия, аммиак) и органических (мочевина, мочевая кислота, креатинин, холестерин, летучие жирные кислоты, некоторые аминокислоты, белки) веществ. Химический состав пота непостоянен и изменяется в зависимости от обмена веществ в организме. В ходе интенсивных тренировок, соревнований с потом выделяются повышенные количества белков, азотистых веществ и свободных аминокислот.
Реактивы: 0,1 % - ный раствор нингидрина в ацетоне.
Ход работы: Кусочек фильтровальной бумаги размером 3х3 см сжимают большим и указательным пальцами так, чтобы на ней остались отпечатки (мыть руки перед опытом не следует, чтобы не удалить пот). Затем, взяв бумажку пинцетом, смачивают ее из пипетки 0,1 % - ным раствором нингидрина в ацетоне, слегка подкисленном уксусной кислотой (0,1 мл 80 % - ной уксусной кислоты на 10 мл раствора нингидрина). Кладут бумажку на часовое стекло (или чашку Петри) и ставят в термостат при 60оС. Через некоторое время на месте отпечатка пальцев появляется красно-фиолетовое пятно.
