
- •Федеральное агентство по рыболовству
- •Принципы молекулярной логики живого
- •Глава 1 химический состав организмов
- •Важнейшие классы органических соединений
- •Структура, свойства и биологические функции воды
- •Содержание основных катионов и анионов внутри клетки и во внеклеточных жидкостях организма человека (по а.Е. Строеву)
- •Вопросы для самоконтроля
- •Глава 2 белки
- •Протеиногенные аминокислоты
- •Классификация протеиногенных аминокислот
- •Химические свойства аминокислот
- •Сложные белки
- •Вопросы и задания для самоконтроля к главе 2 «белки»
- •Глава 3 нуклеиновые кислоты
- •Функции мононуклеотидов
- •Вопросы для самоконтроля к главе 3
- •Глава 4 Биосинтез белка
- •Вопросы для самоконтроля к главе 4 «Биосинтез белка»
- •Глава 5 Биологический катализ. Ферменты
- •Строение фермента
- •Классификация ферментов.
- •Свойства ферментов
- •Регуляция активности ферментов
- •Вопросы для самоконтроля к главе 5 «Биологический катализ. Ферменты»
- •Глава 6 витамины
- •Витамины, их коферментные формы и катализируемые реакции
- •Вопросы для самоконтроля к главе 6 «Витамины»
- •Глава 7 Углеводы Классификация углеводов, строение, свойства
- •Вопросы для самоконтроля к главе 7 «Углеводы»
- •Глава 8 Обмен веществ и энергии. Обмен углеводов
- •Обмен углеводов Переваривание и всасывание углеводов
- •Дихотомический путь распада глюкозы
- •Цикл Кребса (цтк)
- •Дыхательная цепь (электронтранспортная цепь)
- •Прямой путь окисления глюкозы (пентозофосфатный цикл).
- •Вопросы для самоконтроля к главе 8 «Обмен веществ и энергии. Обмен углеводов»
- •Глава 9 Липиды
- •Некоторые природные жирные кислоты
- •Вопросы для самоконтроля к главе 9 «Липиды»
- •Глава 10 обмен жиров Внешний обмен жиров
- •Метаболизм глицерина
- •Окисление жирных кислот
- •Синтез жиров
- •Вопросы для самоконтроля к главе 10 «Обмен жиров»
- •Глава 11 обмен белков
- •Распад белков в тканях
- •Вопросы для самоконтроля к главе 11 «Обмен белков»
- •Глава 12 гормоны. Взаимосвязь процессов обмена веществ
- •Пептидные гормоны
- •Гормоны – производные аминокислот (прочие гормоны)
- •Фитогормоны
- •Регуляция секреции гормонов
- •Взаимосвязь процессов обмена веществ
- •Вопросы для самоконтроля к главе 12 «Гормоны. Взаимосвязь процессов обмена веществ»
- •Практикум
- •Техника безопасности работы в биохимической лаборатории
- •Рабочий журнал
- •Лабораторная работа № 1 цветные реакции на белки
- •Вопросы к лабораторной работе «Цветные реакции на белки»
- •Лабораторная работа № 2 реакции осаждения белков
- •Вопросы к лабораторной работе «Реакции осаждения белков»
- •Лабораторная работа № 3 нуклеопротеиды
- •Дифениламиновая проба (реакция Дише)
- •Проба Троммера
- •Реакция Толленса
- •Вопросы к лабораторной работе «Качественные реакции на отдельные ферменты»
- •Лабораторная работа № 5 количественное определение аскорбиновой кислоты
- •Вопросы к лабораторной работе «Количественное определение аскорбиновой кислоты»
- •Лабораторная работа № 6 Количественное определение углеводов
- •Содержание глюкозы в 0,1 мл вытяжки, в мг
- •Вопросы к лабораторной работе «Количественное определение углеводов»
- •Лабораторная работа №7 жировые константы Определение йодного числа жира
- •Определение кислотного числа жира
- •Вопросы к лабораторной работе «Жировые константы»
- •Рекомендуемая литература
Дифениламиновая проба (реакция Дише)
Метод основан на способности дезоксирибозы ДНК образовывать соединения синего цвета с дифениламином при нагревании в среде, содержащей смесь ледяной уксусной и концентрированной серной кислот. С рибозой РНК аналогичная реакция дает зеленое окрашивание.
Ход работы: К 10 каплям гидролизата приливают 0,5–1 мл дифениламинового реактива. Содержимое пробирки перемешивают и нагревают на водяной бане в течение 15–20 минут. Отмечают характерное окрашивание. Для приготовления дифениламинового реактива 1 г дифениланилина растворяют в 100 мл ледяной уксусной кислоты и к раствору добавляют 2,75 мл концентрированной серной кислоты.
Проба Троммера
Эта проба, как и две последующих, основана на способности рибозы и дезоксирибозы, имеющих свободный гликозидный гидроксил, восстанавливать в щелочной среде окисные формы металлов (Cu, Fe, Bi) до закисных, а закисные – до свободного состояния. Сахара же в этих условиях дают различные продукты окисления.
Проба Троммера основана на реакциях:

Избыток CuSO4 мешает реакции, т. к. ведет к образованию большого количества Cu(OH)2, который при нагревании распадается с образованием черного осадка CuO:
![]()
Ход работы К 5 каплям гидролизата добавляют 5 капель 30 %-го раствора NaOH и несколько капель 7 %-го раствора CuSO4 до появления неисчезающей мути Cu(OH)2. При нагревании до кипения выпадает черный осадок CuOH или красный осадок Cu2O.
Реакция Толленса
Реакция Толленса является специфичной для пентоз. Она обусловлена взаимодействием флороглюцина с фурфуролом, образующимся из пентозы при нагревании с HCl. При этом образуется продукт конденсации красного цвета.
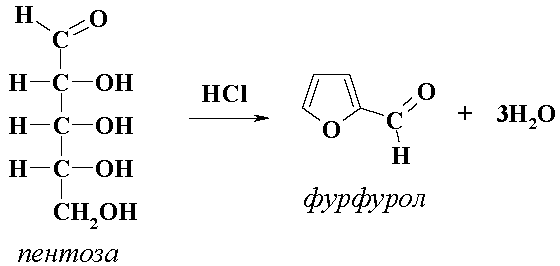
Ход работы. В пробирку вносят 5–7 капель гидролизата, 2–3 капли 0,5 %-го раствора флороглюцина в концентрированной HCl и кипятят в течение 1 минуты.
Наблюдают за изменением окраски.
МОЛИБДЕНОВАЯ ПРОБА НА ФОСФОРНУЮ КИСЛОТУ
Приготовление молибденового реактива
В 100 мл дистиллированной воды растворяют 7,5 г молибдата аммония и добавляют 100 мл 32 %-го раствора HNO3 плотностью 1,2 г/см3.
Ход работы. В пробирку вносят 5 капель гидролизата дрожжей, добавляют 10–20 капель молибденового реактива и кипятят в течение нескольких минут. При охлаждении пробирки под струей воды выпадает кристаллический осадок фосфорной соли молибдата аммония лимонно-желтого цвета:
![]()
Вопросы к лабораторной работе
«Нуклеопротеиды»
Как определяется белковая природа нуклеопротеидов?
Что образуется при полном гидролизе нуклеопротеидов?
Что такое нуклеозиды?
Что такое мононуклеотиды?
Какие азотистые основания входят в состав нуклеиновых кислот?
ЛАБОРАТОРНАЯ РАБОТА № 4
КАЧЕСТВЕННЫЕ РЕАКЦИИ НА ОТДЕЛЬНЫЕ ФЕРМЕНТЫ
Цель работы: ознакомиться с каталитическим действием некоторых ферментов пищеварительного тракта (амилазы слюны, пепсина и липазы) и каталазы крови.
Техника безопасности
1. Соблюдайте особую осторожность при работе с раствором Люголя (йода), с раствором перекиси водорода
2. Будьте внимательны при нагревании растворов.
Опыт № 1. Амилаза слюны
Амилаза слюны осуществляет гидролиз крахмала или гликогена.
Ход работы. В две пробирки вносят по 5 мл 0,2 %-го раствора крахмала, в одну из них добавляют 0,5 мл слюны. Содержимое перемешивают и пробы помещают в водяную баню (37оС) на 15 минут.
В обе пробирки добавляют по 5 капель раствора Люголя (йода). В пробирке со слюной (амилазой) раствор не дает реакции на полисахарид, а в пробирке без слюны образуется сине-фиолетовое окрашивание.
Опыт №2. Липаза поджелудочной железы
Липаза гидролизует жиры на глицерин и жирные кислоты, количество которых можно определить титрованием щелочью.
Ход работы. В две пробирки вносят по 1 мл растительного масла, 4 мл дистиллированной Н2О, 5 мл 1%-го раствора NaHCO3. Содержимое энергично встряхивают до образования эмульсии. Затем в обе пробирки добавляют по 5 капель спиртового раствора фенолфталеина, в одну из пробирок (опыт) - 1 мл липазы, а в другую (контроль) - 1 мл Н2О. Содержимое тщательно перемешивают и ставят в термостат (37оС) на 15-20 минут. Вследствие образования жирных кислот в ходе реакции и нейтрализации ими щелочной среды раствор в пробе с липазой становится менее окрашенным или обесцвечивается, а в пробе без липазы не изменяется.
Опыт №3. ПЕПСИН
Пепсин, фермент желудочного сока, гидролизует белки до пептидов и аминокислот.
Ход работы. В две пробирки вносят несколько мл раствора белка (альбумина) и легким подогревом на спиртовке или электроплитке денатурируют его. Пробы охлаждают до комнатной температуры и в одну из них добавляют раствор пепсина, а в другую - 1 мл Н2О. Обе пробы помещают в термостат (37оС) на 20 минут, после чего сравнивают результаты.
Опыт №4. КАТАЛАЗА
Каталаза инактивирует перекись водорода, разлагая ее на воду и молекулярный кислород:
2Н2О2 = 2Н2О + О2.
Перекись водорода образуется в некоторых окислительно – восстановительных процессах при восстановлении молекулярного кислорода. Это вещество является сильным клеточным ядом, т.е. обладает цитотоксическим действием. Из перекиси водорода образуется гидроксильный радикал - ОН - высокореакционноспособный оксидант. Таким образом, каталаза, удаляя этот ядовитый продукт, защищает биохимические системы клетки от неконтролируемых самопроизвольных окислительных процессов. Этот фермент содержится в эритроцитах, в клетках печени и других тканей.
Ход работы. В две пробирки вносят по 2 мл свежеприготовленного 5%-го раствора перекиси водорода, в одну из проб добавляют 1 каплю крови и перемешивают. В пробе с кровью (каталазой) вследствие выделения кислорода наблюдается интенсивное образование пузырьков.
