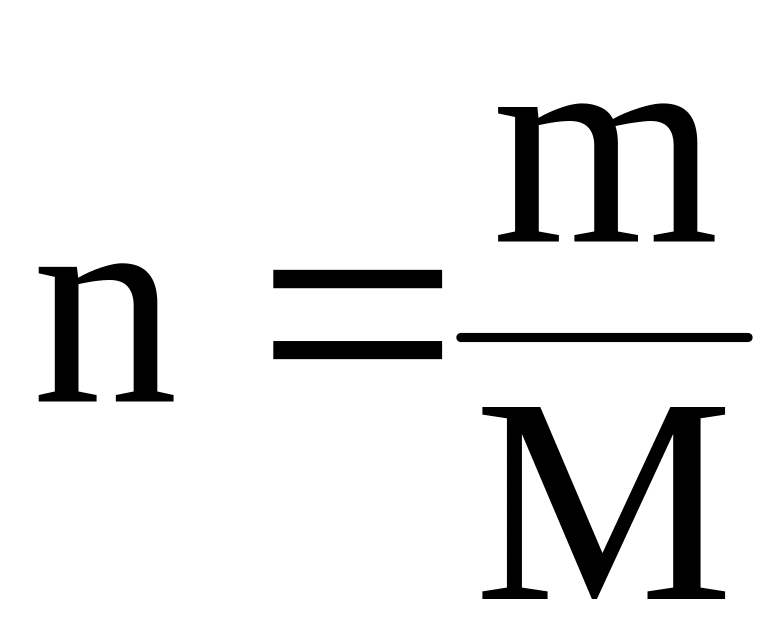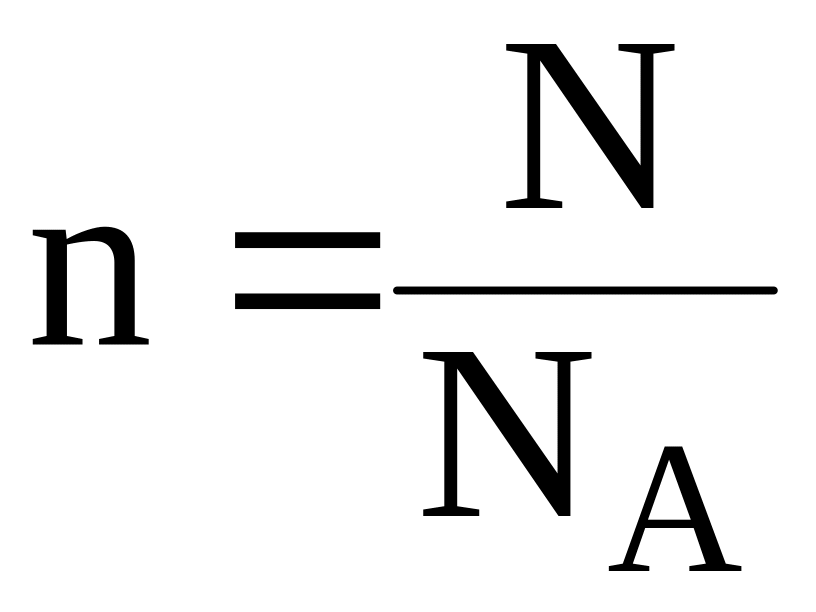- •Глава 1. Основные понятия химии
- •1.1. Составление химических формул веществ. Понятие о валентности и степени окисления
- •Задание для самостоятельной работы
- •1.2. Химические уравнения
- •1.3. Классификация химических реакций
- •Глава 2. Основные классы неорганических соединений
- •2.1. Оксиды
- •2.1.1. Получение оксидов
- •2.1.2. Классификация и свойства оксидов
- •I. Оксиды металлов.
- •1. Оснóвные оксиды.
- •2. Кислотные оксиды.
- •3. Амфотерные оксиды.
- •II. Оксиды неметаллов.
- •2.2. Гидроксиды
- •I. Гидроксиды металлов.
- •2.2.1. Получение гидроксидов металлов
- •1. Оснóвные гидроксиды.
- •2. Кислотные гидроксиды.
- •3. Амфотерные гидроксиды.
- •II. Гидроксиды неметаллов.
- •2.2.2. Получение кислот
- •2.3. Соли
- •2.3.1. Классификация солей
- •1. Средние (нормальные) соли.
- •2. Кислые соли.
- •3. Оснóвные соли.
- •4. Комплексные соли.
- •5. Двойные соли.
- •6. Смешанные соли.
- •7. Гидратные соли (кристаллогидраты).
- •2.3.2. Физические свойства солей
- •2.3.3. Химические свойства солей
- •Задание для самостоятельной работы
- •Глава 3. Основные законы химии
- •3.1. Международная система единиц (система си)
- •3.2. Атомные и молекулярные массы
- •1. Атомная (или молекулярная) масса m0.
- •2. Относительная атомная (или молекулярная) масса Ar (Mr).
- •3. Молярная масса вещества m.
- •1. Закон сохранения массы веществ.
- •2. Закон постоянства состава.
- •3. Закон стехиометрических соотношений.
- •3.4. Газовые законы
- •Решение.
- •Глава 4. Строение Атома
- •Решение.
- •4.1. Строение электронных оболочек атомов
- •4.2. Электронные конфигурации атомов
- •1. Принцип Паули.
- •2. Правило Хунда.
- •3. Принцип наименьшей энергии.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •4.3. Периодический закон д.И.Менделеева
- •Задание для самостоятельной работы
- •Глава 5. Химическая связь
- •5.1. Ковалентная связь
- •1. Обменный механизм.
- •2. Донорно-акцепторный механизм.
- •5.2. Ионная связь
- •5.3. Металлическая связь
- •5.4. Водородная связь
- •Решение.
- •Задание для самостоятельной работы
- •Глава 6. Физико-химические основы протекания химических реакций
- •6.1. Основы химической термодинамики
- •6.1.1. Термохимические уравнения и расчеты
- •I следствие:
- •Решение.
- •II следствие:
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.2. Скорость химических реакций
- •6.2.1. Основы химической кинетики
- •Решение.
- •1. Зависимость скорости реакции от концентраций реагентов.
- •Решение.
- •Решение.
- •Решение.
- •2. Зависимость скорости реакции от температуры.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.3. Химическое равновесие
- •6.3.1. Смещение химического равновесия. Принцип Ле Шателье
- •1. Влияние изменения концентрации.
- •2. Влияние температуры.
- •2. Влияние давления.
- •Решение.
- •Задача №3
- •Задача №4
- •Задание для самостоятельной работы
- •Глава 7. Растворы
- •7.1. Основные способы выражения концентрации растворов
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •7.2. Теория электролитической диссоциации
- •7.2.1. Факторы, влияющие на степень диссоциации электролитов
- •Решение.
- •7.2.2. Реакции в растворах электролитов
- •Решение.
- •7.3. Ионное произведение воды. Водородный показатель
- •Решение.
- •Решение.
- •Шкала значений pH
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •7.4.1. Усиление и подавление гидролиза
- •Решение.
- •Задание для самостоятельной работы
- •Глава 8. Окислительно-восстановительные реакции
- •8.1. Окислители и восстановители
- •8.2. Классификация окислительно-восстановительных реакций
- •8.3.2. Метод электронно-ионного баланса
- •Решение.
- •Задание для самостоятельной работы
3. Молярная масса вещества m.
В международной системе единиц (СИ) за единицу количества вещества принят моль.
Моль это количество вещества, содержащее столько же частиц (молекул, атомов, ионов, электронов и т.д.), сколько атомов углерода содержится в 12 г изотопа 12С.
Число атомов в 12 г изотопа углерода 12С равно 6,021023. Эта физическая величина называется постоянной Авогадро (или числом Авогадро), обозначается NA, и имеет размерность 1/моль или моль1.
Молярная масса это масса одного моль вещества. Ее можно рассчитать по формуле:
M(X) = m0(Х)NA |
(2) |
где m0(Х) молекулярная масса вещества Х;
NA постоянная Авогадро.
Отметим, что молярная масса численно равна относительной молекулярной массе, но при этом имеет размерность [г/моль]. Таким образом, для Al2(SO4)3 M = Мr = 342 г/моль.
Соотношение между количеством вещества (n) и его массой m выражается формулой:
|
(3) |
Количество вещества также можно определить, зная число его частиц:
|
(4) |
Пример 1. Определить элемент, атом которого имеет массу 2,6610–23 г.
Решение.
По формуле (2) найдем молярную массу элемента:
M(X) = m(Х)NA = 2,6610–236,021023 16 г/моль.
В Периодической таблице Д.И.Менделеева находим, что данный элемент кислород.
Пример 2. Найти количество Н2SO4, если масса вещества равна 9,8 г.
Решение.
По формуле (3) находим:
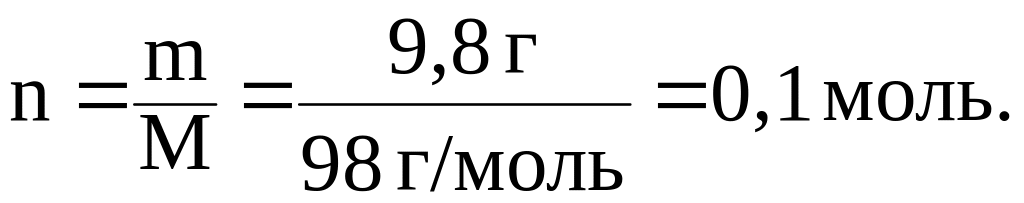
Пример 3. Найти массу НCl, если количество вещества равно 0,2 моль.
Решение.
По формуле (3) находим:
![]()
Пример 4. Найти число молекул, содержащихся в 0,05 моль НNO3.
Решение.
По формуле 4 находим:
![]()
Пример 5. Найти массу Cl2, если число молекул вещества равно 1,21022.
Решение.
Из формул (3) и (4) следует:
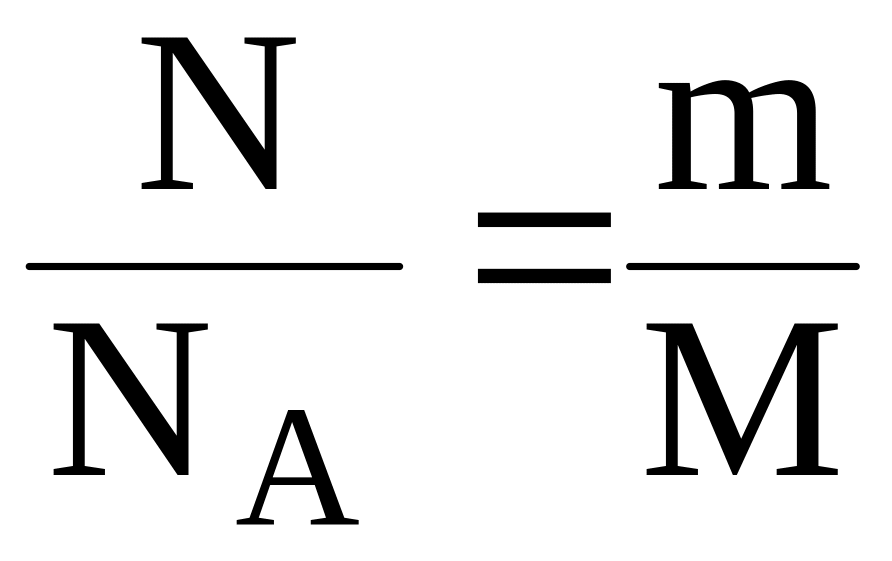 .
.
Отсюда:
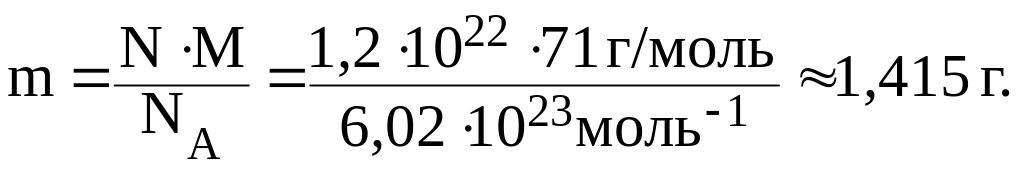
Задание для самостоятельной работы
1. Найти массу молекулы O3.
2. Определить элемент, атом которого имеет массу 1,8310–26 кг.
3. Найти количество Na2CO3, если масса вещества равна 5,3 г.
4. Найти массу NaCl, если количество вещества равно 0,4 моль.
5. Найти число молекул, содержащихся в 0,025 моль Н3PO4.
6. Найти массу He, если число молекул вещества равно 2,41024.
3.3. Основные стехиометрические законы химии
Стехиометрия это раздел химии, в котором рассматриваются массовые или объемные отношения между реагирующими веществами.
1. Закон сохранения массы веществ.
Массы веществ, вступивших в реакцию, равны массе веществ, образовавшихся в результате реакции.
2. Закон постоянства состава.
Каждое чистое соединение имеет один и тот же состав, независимо от способа его получения.
3. Закон стехиометрических соотношений.
Отношение количеств реагирующих веществ (в молях) равно отношению соответствующих коэффициентов в уравнении реакции.
Пример 1. Найти количество гидроксида натрия, которое потребуется для полной нейтрализации 5 моль серной кислоты.
Решение.
Из уравнения реакции:
H2SO4 + 2NaOH = Na2SO4 + 2H2O
видно, что на нейтрализацию 1 моль H2SO4 затрачивается 2 моль NaOH. Согласно закону стехиометрических соотношений:
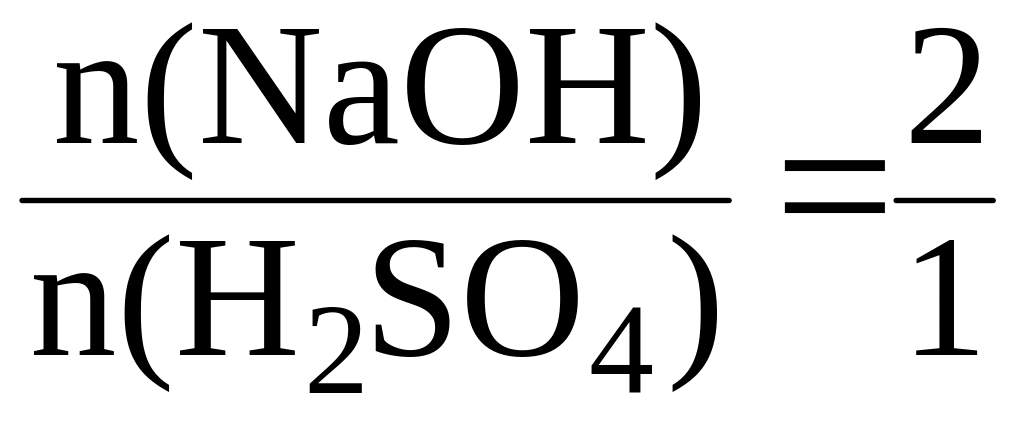 .
.
Отсюда следует, что на нейтрализацию 5 моль H2SO4 потребуется 10 моль NaOH:
![]()
Пример 2. Найти массу FeCl3, вступившего в реакцию с 0,3 моль гидроксида калия.
Решение.
Запишем уравнение реакции:
FeCl3 + 3KOH = Fe(OH)3↓ + 3KCl
Согласно закону стехиометрических соотношений:
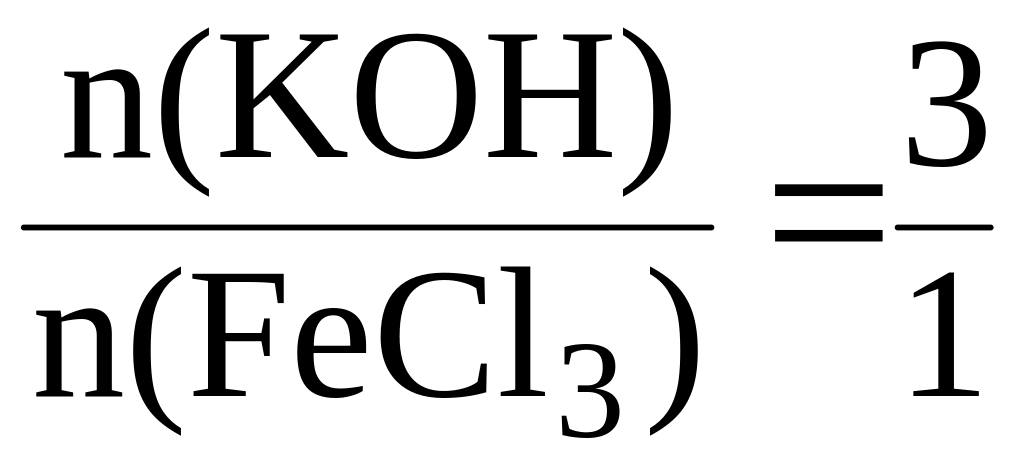 .
.
Отсюда:
![]()
Из уравнения (3):
![]()
Пример 3. Хлорид бария массой 6,24 г прореагировал с избытком сульфата железа (III). Найти массу образовавшихся осадка и хлорида железа (III).
Решение.
Запишем уравнение реакции:
3BaCl2 + Fe2(SO4)3 = 3BaSO4↓ + 2FeCl3
Согласно закону стехиометрических соотношений:
![]() .
.
Количество BaCl2 равно:
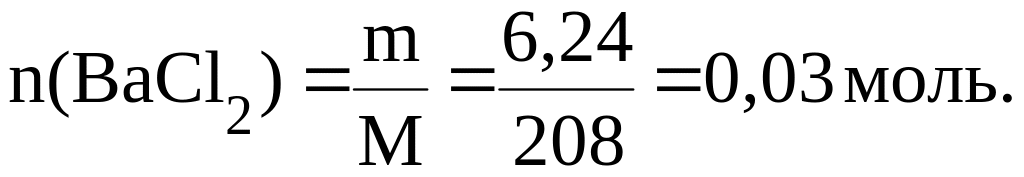
Тогда:
![]()
Аналогично:
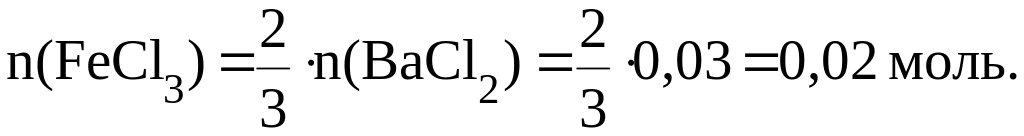
![]()
Пример 4. Найти массу нитрата натрия, в которой содержится 6 г кислорода.
Решение.
Из формулы нитрата натрия NaNO3 следует, что в 1 моль соединения содержится 3 моль атомов кислорода. Тогда:
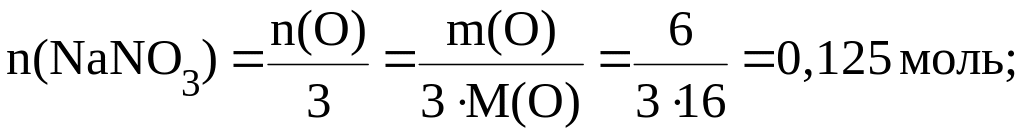
![]()
Задание для самостоятельной работы
1. Найти массу сульфата меди, содержащего 6,4 г кислорода.
2. Найти массу сульфата бария, которая образуется при взаимодействии раствора хлорида бария, содержащего 62,4 г соли с избытком раствора сульфата алюминия.
3. При растворении алюминия в разбавленной серной кислоте образовалось 0,171 г соли. Найти массы прореагировавших Al и H2SO4.
4. Найти массу фосфора, которую необходимо сжечь, чтобы получить оксид фосфора (V) массой 7,1 г.