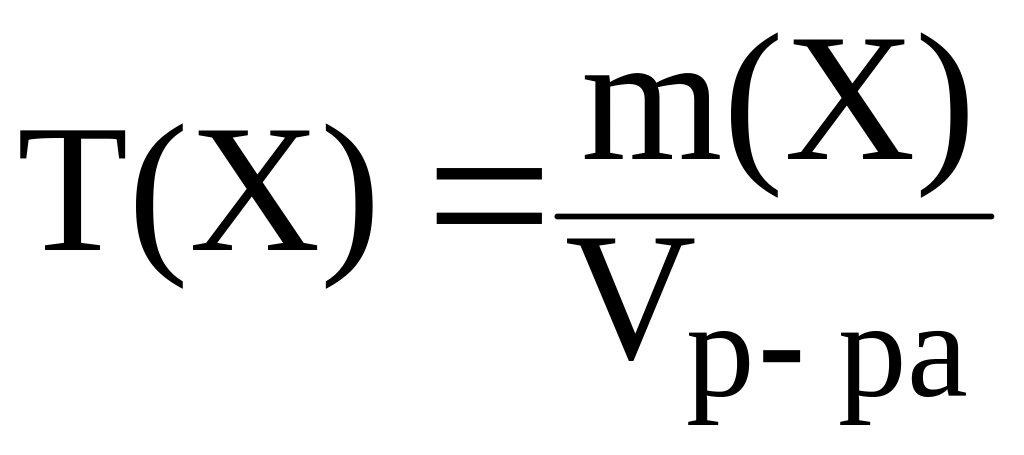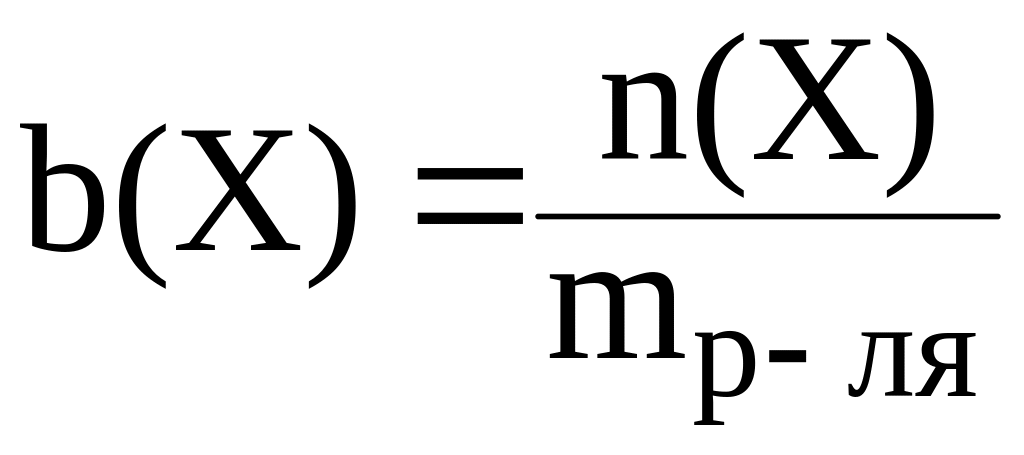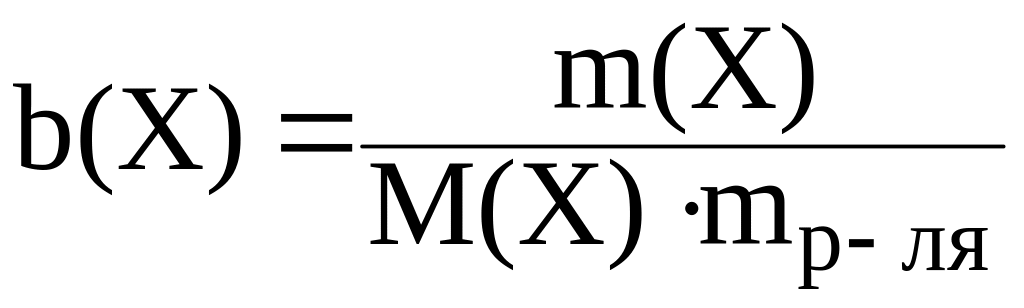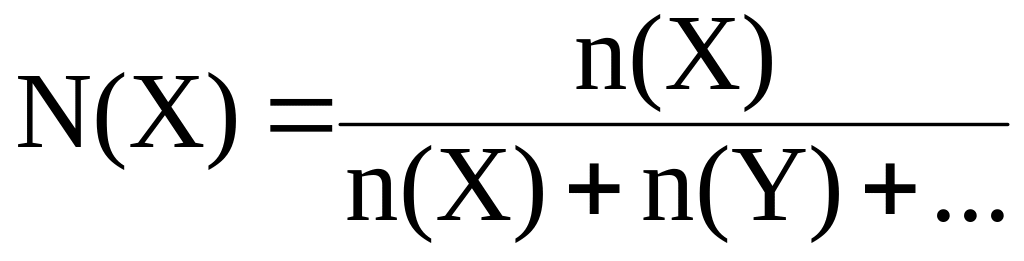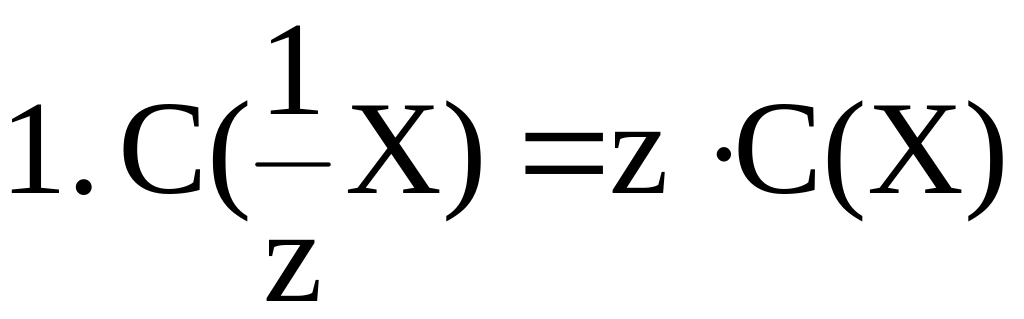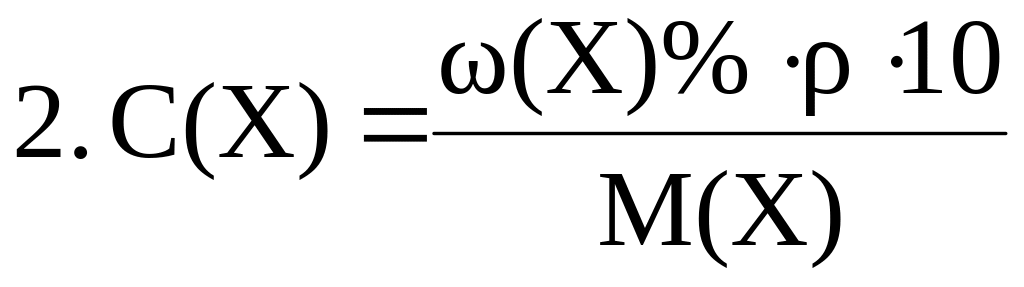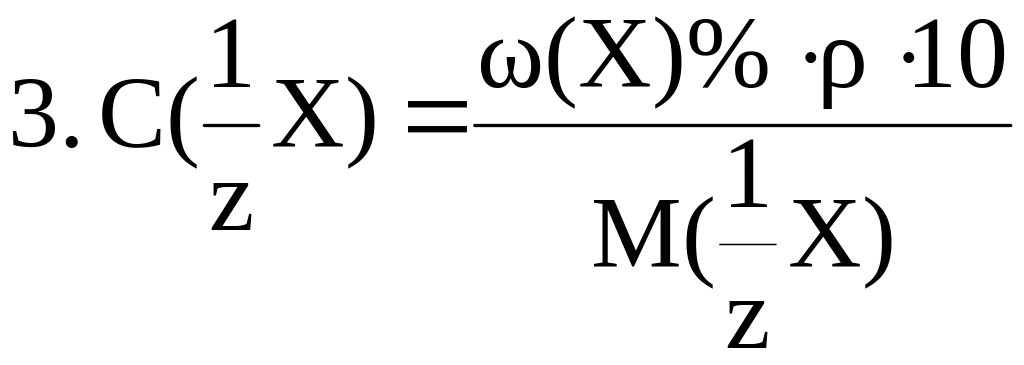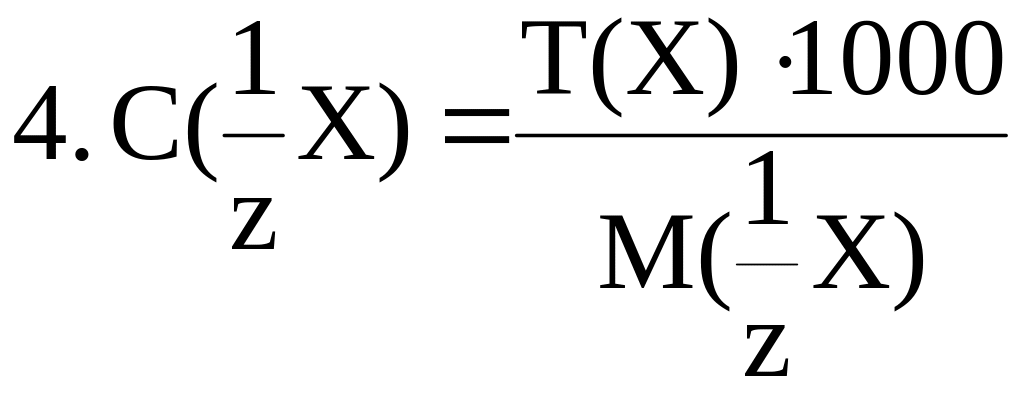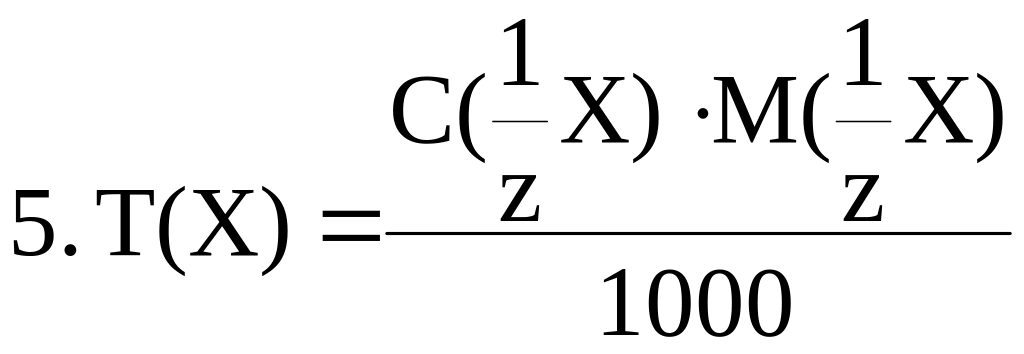- •Глава 1. Основные понятия химии
- •1.1. Составление химических формул веществ. Понятие о валентности и степени окисления
- •Задание для самостоятельной работы
- •1.2. Химические уравнения
- •1.3. Классификация химических реакций
- •Глава 2. Основные классы неорганических соединений
- •2.1. Оксиды
- •2.1.1. Получение оксидов
- •2.1.2. Классификация и свойства оксидов
- •I. Оксиды металлов.
- •1. Оснóвные оксиды.
- •2. Кислотные оксиды.
- •3. Амфотерные оксиды.
- •II. Оксиды неметаллов.
- •2.2. Гидроксиды
- •I. Гидроксиды металлов.
- •2.2.1. Получение гидроксидов металлов
- •1. Оснóвные гидроксиды.
- •2. Кислотные гидроксиды.
- •3. Амфотерные гидроксиды.
- •II. Гидроксиды неметаллов.
- •2.2.2. Получение кислот
- •2.3. Соли
- •2.3.1. Классификация солей
- •1. Средние (нормальные) соли.
- •2. Кислые соли.
- •3. Оснóвные соли.
- •4. Комплексные соли.
- •5. Двойные соли.
- •6. Смешанные соли.
- •7. Гидратные соли (кристаллогидраты).
- •2.3.2. Физические свойства солей
- •2.3.3. Химические свойства солей
- •Задание для самостоятельной работы
- •Глава 3. Основные законы химии
- •3.1. Международная система единиц (система си)
- •3.2. Атомные и молекулярные массы
- •1. Атомная (или молекулярная) масса m0.
- •2. Относительная атомная (или молекулярная) масса Ar (Mr).
- •3. Молярная масса вещества m.
- •1. Закон сохранения массы веществ.
- •2. Закон постоянства состава.
- •3. Закон стехиометрических соотношений.
- •3.4. Газовые законы
- •Решение.
- •Глава 4. Строение Атома
- •Решение.
- •4.1. Строение электронных оболочек атомов
- •4.2. Электронные конфигурации атомов
- •1. Принцип Паули.
- •2. Правило Хунда.
- •3. Принцип наименьшей энергии.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •4.3. Периодический закон д.И.Менделеева
- •Задание для самостоятельной работы
- •Глава 5. Химическая связь
- •5.1. Ковалентная связь
- •1. Обменный механизм.
- •2. Донорно-акцепторный механизм.
- •5.2. Ионная связь
- •5.3. Металлическая связь
- •5.4. Водородная связь
- •Решение.
- •Задание для самостоятельной работы
- •Глава 6. Физико-химические основы протекания химических реакций
- •6.1. Основы химической термодинамики
- •6.1.1. Термохимические уравнения и расчеты
- •I следствие:
- •Решение.
- •II следствие:
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.2. Скорость химических реакций
- •6.2.1. Основы химической кинетики
- •Решение.
- •1. Зависимость скорости реакции от концентраций реагентов.
- •Решение.
- •Решение.
- •Решение.
- •2. Зависимость скорости реакции от температуры.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.3. Химическое равновесие
- •6.3.1. Смещение химического равновесия. Принцип Ле Шателье
- •1. Влияние изменения концентрации.
- •2. Влияние температуры.
- •2. Влияние давления.
- •Решение.
- •Задача №3
- •Задача №4
- •Задание для самостоятельной работы
- •Глава 7. Растворы
- •7.1. Основные способы выражения концентрации растворов
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •7.2. Теория электролитической диссоциации
- •7.2.1. Факторы, влияющие на степень диссоциации электролитов
- •Решение.
- •7.2.2. Реакции в растворах электролитов
- •Решение.
- •7.3. Ионное произведение воды. Водородный показатель
- •Решение.
- •Решение.
- •Шкала значений pH
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •7.4.1. Усиление и подавление гидролиза
- •Решение.
- •Задание для самостоятельной работы
- •Глава 8. Окислительно-восстановительные реакции
- •8.1. Окислители и восстановители
- •8.2. Классификация окислительно-восстановительных реакций
- •8.3.2. Метод электронно-ионного баланса
- •Решение.
- •Задание для самостоятельной работы
Решение.
1)
Фактор эквивалентности FeCl3
равен:
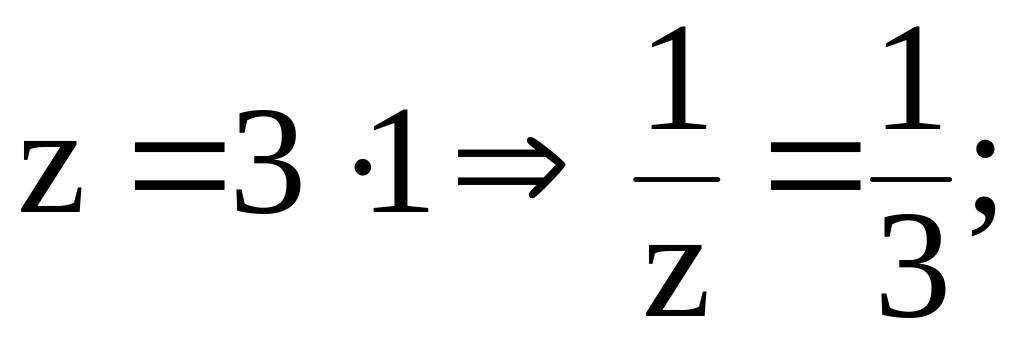
2)
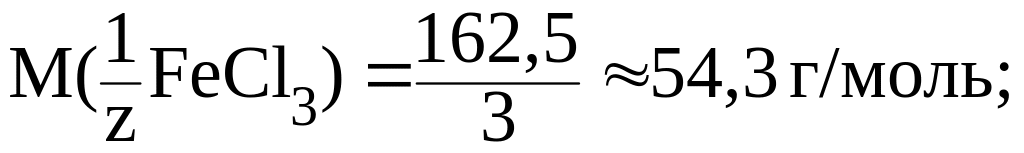
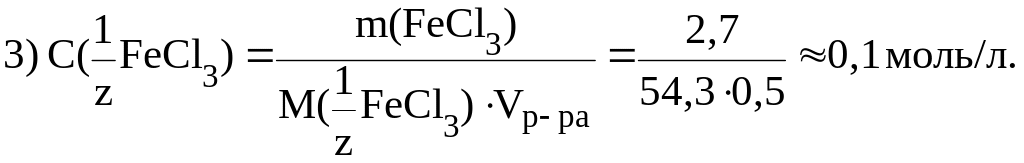
4. Титр Т(X) – это отношение массы вещества к объему раствора:
|
(22) |
Размерность титра – г/мл.
Пример 1. Рассчитать объем раствора с Т(NaOH) = 0,004 г/мл, содержащего щелочь массой 0,5 г.
Решение.
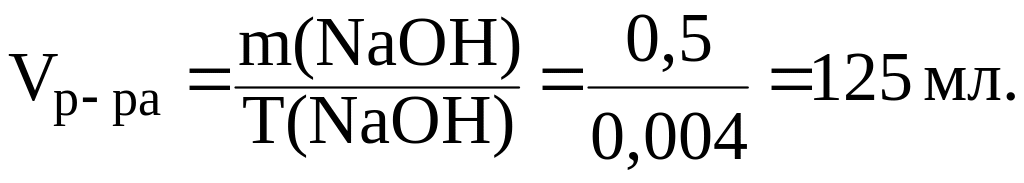
5. Моляльная концентрация (моляльность) b(х) – это отношение количества растворенного вещества к массе растворителя:
|
(23) |
или:
|
(23) |
Моляльная концентрация выражается в моль/кг и показывает какое количество растворенного вещества приходится на 1 кг растворителя.
Пример 1. 3,6 г глюкозы C6H12O6 растворили в 250 г воды. Найти моляльную концентрацию раствора.
Решение.
По формуле (23):
![]()
6. Мольная доля N(x) – это отношение количества вещества данного компонента, содержащегося в системе, к общему количеству веществ системы:
|
(24) |
Выражается в долях единицы.
Пример 1. 17 г AgNO3 растворили в 360 г воды. Найти мольную долю соли.
Решение.
![]()
![]()
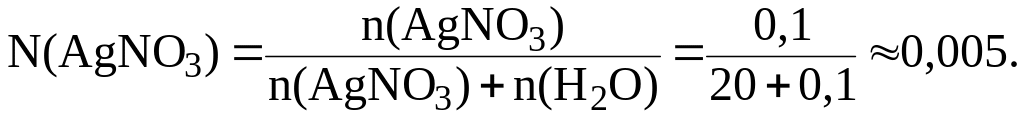
7. Коэффициентом растворимости вещества Р(Х) называют максимальную массу вещества, выраженную в г, которая может раствориться в 100 г растворителя.
Между различными способами выражения концентрации растворов существует взаимосвязь. Некоторые формулы пересчета концентраций приведены ниже.
|
|
Пример 1. Рассчитать молярную концентрацию 10% раствора NaCl плотностью 1,08 г/мл.
Решение.
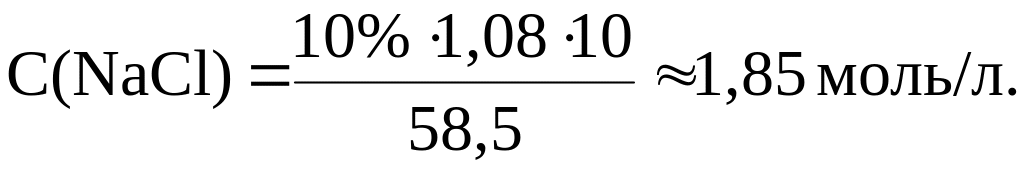
Приготовление растворов заданных концентраций
Приготовить раствор с известной концентрацией можно следующими способами:
1) по навеске соли или кристаллогидрата соли;
2) разбавлением концентрированного раствора.
Пример 1. Приготовить 200 мл раствора NaHCO3 с C(NaHCO3) 0,1 моль/л из навески сухой соли.
Решение.
Чтобы приготовить раствор заданной концентрации необходимо рассчитать массу содержащегося в нем растворенного вещества.
Из формулы (20):
m(NaHCO3)
С(NaHCO3)·M(NaHCO3)![]()
0,1·84·0,2
1,68 г.
0,1·84·0,2
1,68 г.
Пример 2. Приготовить 250 мл раствора CuSO4 с C( CuSO4) = 0,1 моль/л из кристаллогидрата CuSO4·5Н2О.
Решение.
![]()
2) найдем массу безводного CuSO4 в растворе:
m(CuSO4)
C(![]() CuSO4)·M(
CuSO4)
0,1·80·0,25
2 г;
CuSO4)·M(
CuSO4)
0,1·80·0,25
2 г;
3) найдем массу кристаллогидрата, содержащего 2 г CuSO4:
M(CuSO4·H2O) 160 5·18 250 г/моль;
Так как в 1 моль кристаллогидрата содержится 1 моль соли, то согласно закону стехиометрических соотношений:
![]() ;
;
Отсюда:
![]() .
.
В некоторых случаях приготовить раствор по навеске не представляется возможным (например, растворы HCl или H2O2). В таких случаях прибегают к разбавлению концентрированных растворов.
Пример 1. Вычислить массу воды, которую необходимо добавить к 200 г раствора NaCl с (NaCl) 2%, чтобы получить раствор с (NaCl) 0,9%.
Решение.
1) в исходном растворе:
![]()

![]()
Пример 2. Приготовить 250 мл раствора H2SO4 с C(H2SO4) 0,1 моль/л из раствора H2SO4 с (H2SO4) 10% плотностью 1,2 г/мл.