
- •Глава 1. Основные понятия химии
- •1.1. Составление химических формул веществ. Понятие о валентности и степени окисления
- •Задание для самостоятельной работы
- •1.2. Химические уравнения
- •1.3. Классификация химических реакций
- •Глава 2. Основные классы неорганических соединений
- •2.1. Оксиды
- •2.1.1. Получение оксидов
- •2.1.2. Классификация и свойства оксидов
- •I. Оксиды металлов.
- •1. Оснóвные оксиды.
- •2. Кислотные оксиды.
- •3. Амфотерные оксиды.
- •II. Оксиды неметаллов.
- •2.2. Гидроксиды
- •I. Гидроксиды металлов.
- •2.2.1. Получение гидроксидов металлов
- •1. Оснóвные гидроксиды.
- •2. Кислотные гидроксиды.
- •3. Амфотерные гидроксиды.
- •II. Гидроксиды неметаллов.
- •2.2.2. Получение кислот
- •2.3. Соли
- •2.3.1. Классификация солей
- •1. Средние (нормальные) соли.
- •2. Кислые соли.
- •3. Оснóвные соли.
- •4. Комплексные соли.
- •5. Двойные соли.
- •6. Смешанные соли.
- •7. Гидратные соли (кристаллогидраты).
- •2.3.2. Физические свойства солей
- •2.3.3. Химические свойства солей
- •Задание для самостоятельной работы
- •Глава 3. Основные законы химии
- •3.1. Международная система единиц (система си)
- •3.2. Атомные и молекулярные массы
- •1. Атомная (или молекулярная) масса m0.
- •2. Относительная атомная (или молекулярная) масса Ar (Mr).
- •3. Молярная масса вещества m.
- •1. Закон сохранения массы веществ.
- •2. Закон постоянства состава.
- •3. Закон стехиометрических соотношений.
- •3.4. Газовые законы
- •Решение.
- •Глава 4. Строение Атома
- •Решение.
- •4.1. Строение электронных оболочек атомов
- •4.2. Электронные конфигурации атомов
- •1. Принцип Паули.
- •2. Правило Хунда.
- •3. Принцип наименьшей энергии.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •4.3. Периодический закон д.И.Менделеева
- •Задание для самостоятельной работы
- •Глава 5. Химическая связь
- •5.1. Ковалентная связь
- •1. Обменный механизм.
- •2. Донорно-акцепторный механизм.
- •5.2. Ионная связь
- •5.3. Металлическая связь
- •5.4. Водородная связь
- •Решение.
- •Задание для самостоятельной работы
- •Глава 6. Физико-химические основы протекания химических реакций
- •6.1. Основы химической термодинамики
- •6.1.1. Термохимические уравнения и расчеты
- •I следствие:
- •Решение.
- •II следствие:
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.2. Скорость химических реакций
- •6.2.1. Основы химической кинетики
- •Решение.
- •1. Зависимость скорости реакции от концентраций реагентов.
- •Решение.
- •Решение.
- •Решение.
- •2. Зависимость скорости реакции от температуры.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.3. Химическое равновесие
- •6.3.1. Смещение химического равновесия. Принцип Ле Шателье
- •1. Влияние изменения концентрации.
- •2. Влияние температуры.
- •2. Влияние давления.
- •Решение.
- •Задача №3
- •Задача №4
- •Задание для самостоятельной работы
- •Глава 7. Растворы
- •7.1. Основные способы выражения концентрации растворов
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •7.2. Теория электролитической диссоциации
- •7.2.1. Факторы, влияющие на степень диссоциации электролитов
- •Решение.
- •7.2.2. Реакции в растворах электролитов
- •Решение.
- •7.3. Ионное произведение воды. Водородный показатель
- •Решение.
- •Решение.
- •Шкала значений pH
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •7.4.1. Усиление и подавление гидролиза
- •Решение.
- •Задание для самостоятельной работы
- •Глава 8. Окислительно-восстановительные реакции
- •8.1. Окислители и восстановители
- •8.2. Классификация окислительно-восстановительных реакций
- •8.3.2. Метод электронно-ионного баланса
- •Решение.
- •Задание для самостоятельной работы
Решение.
Чтобы установить какие связи присутствуют в молекуле надо изобразить ее структурную формулу. Исходя из того, что серная кислота является двухосновной (содержит две OH-группы), а атомы водорода и кислорода имеют постоянную валентность (I и II соответственно), структурная формула серной кислоты выглядит так:
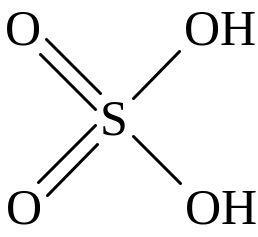
Таким образом, в молекуле H2SO4 имеются 6 -связей (4 связи S O и 2 связи O H) и 2 -связи (S O). Все связи являются ковалентными полярными, самыми непрочными являются -связи. Среди -связей самой непрочной является O H, так как является наиболее поляризованной (x = 3,5 2,1 = 1,4). Этим объясняется сравнительная легкость отщепления протонов водорода H+ в водном растворе.
Атом серы суммарно образует 6 связей (4 -связи и 2 -связи) и валентность атома серы равна VI. Степень окисления серы определим по уравнению:
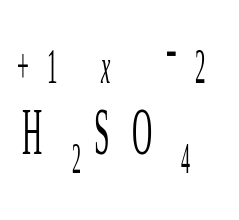
2(+1) + x + 4(2) = 0;
x = +6.
Таким образом, степень окисления серы равна +6.
Задание для самостоятельной работы
1. Определите, какие химические связи присутствуют в следующих соединениях: F2, H3PO4, HClO4, Ca(OH)2, K2SO3, NH4Cl, Сравните прочность связей, укажите валентность и степень окисления атомов P, Ca, S, N, F, Cl.
2. Как изменяется прочность связи в ряду: HF, HCl, HBr, HI? Как это сказывается на свойствах этих веществ?
3. Почему атомы Cl, Br, I могут образовывать соединения, проявляя степени окисления 1; +1; +3; +5 и +7, тогда как атом F проявляет только степень окисления 1?
Глава 6. Физико-химические основы протекания химических реакций
6.1. Основы химической термодинамики
Практически все химические реакции протекают с выделением или с поглощением теплоты. Тепловой эффект реакции обозначают буквой Q и измеряют в Джоулях (Дж) или в кДж.
Реакции, протекающие с выделением теплоты, называют экзотермическими (Q > 0).
Реакции, протекающие с поглощением теплоты, называют эндотермическими (Q < 0).
Раздел науки, изучающий тепловые эффекты химических реакций, называется химической термодинамикой или термохимией.
Основу термохимии составляет закон Гесса:
Тепловой эффект реакции зависит только от природы и состояния исходных веществ и конечных продуктов и не зависит от числа стадий процесса.
В настоящее время вместо понятия «тепловой эффект» используют термин «изменение энтальпии». В изобарных условиях (p = const) изменение энтальпии H равно:
H = U + pV. |
(9) |
где U изменение внутренней энергии.
Это объясняется тем, что большинство химических реакций протекает при постоянном (в частности, атмосферном) давлении.
Энтальпию иначе называют теплосодержанием системы. В экзотермических реакциях теплота выделяется, теплосодержание понижается и H < 0. В эндотермических реакциях теплота, наоборот, поглощается, теплосодержание повышается и H > 0.
Таким образом, в изобарных условиях изменение энтальпии равно тепловому эффекту реакции, взятому с обратным знаком:
H = Qp. |
(10) |
