- •Глава 1. Основные понятия химии
- •1.1. Составление химических формул веществ. Понятие о валентности и степени окисления
- •Задание для самостоятельной работы
- •1.2. Химические уравнения
- •1.3. Классификация химических реакций
- •Глава 2. Основные классы неорганических соединений
- •2.1. Оксиды
- •2.1.1. Получение оксидов
- •2.1.2. Классификация и свойства оксидов
- •I. Оксиды металлов.
- •1. Оснóвные оксиды.
- •2. Кислотные оксиды.
- •3. Амфотерные оксиды.
- •II. Оксиды неметаллов.
- •2.2. Гидроксиды
- •I. Гидроксиды металлов.
- •2.2.1. Получение гидроксидов металлов
- •1. Оснóвные гидроксиды.
- •2. Кислотные гидроксиды.
- •3. Амфотерные гидроксиды.
- •II. Гидроксиды неметаллов.
- •2.2.2. Получение кислот
- •2.3. Соли
- •2.3.1. Классификация солей
- •1. Средние (нормальные) соли.
- •2. Кислые соли.
- •3. Оснóвные соли.
- •4. Комплексные соли.
- •5. Двойные соли.
- •6. Смешанные соли.
- •7. Гидратные соли (кристаллогидраты).
- •2.3.2. Физические свойства солей
- •2.3.3. Химические свойства солей
- •Задание для самостоятельной работы
- •Глава 3. Основные законы химии
- •3.1. Международная система единиц (система си)
- •3.2. Атомные и молекулярные массы
- •1. Атомная (или молекулярная) масса m0.
- •2. Относительная атомная (или молекулярная) масса Ar (Mr).
- •3. Молярная масса вещества m.
- •1. Закон сохранения массы веществ.
- •2. Закон постоянства состава.
- •3. Закон стехиометрических соотношений.
- •3.4. Газовые законы
- •Решение.
- •Глава 4. Строение Атома
- •Решение.
- •4.1. Строение электронных оболочек атомов
- •4.2. Электронные конфигурации атомов
- •1. Принцип Паули.
- •2. Правило Хунда.
- •3. Принцип наименьшей энергии.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •4.3. Периодический закон д.И.Менделеева
- •Задание для самостоятельной работы
- •Глава 5. Химическая связь
- •5.1. Ковалентная связь
- •1. Обменный механизм.
- •2. Донорно-акцепторный механизм.
- •5.2. Ионная связь
- •5.3. Металлическая связь
- •5.4. Водородная связь
- •Решение.
- •Задание для самостоятельной работы
- •Глава 6. Физико-химические основы протекания химических реакций
- •6.1. Основы химической термодинамики
- •6.1.1. Термохимические уравнения и расчеты
- •I следствие:
- •Решение.
- •II следствие:
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.2. Скорость химических реакций
- •6.2.1. Основы химической кинетики
- •Решение.
- •1. Зависимость скорости реакции от концентраций реагентов.
- •Решение.
- •Решение.
- •Решение.
- •2. Зависимость скорости реакции от температуры.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.3. Химическое равновесие
- •6.3.1. Смещение химического равновесия. Принцип Ле Шателье
- •1. Влияние изменения концентрации.
- •2. Влияние температуры.
- •2. Влияние давления.
- •Решение.
- •Задача №3
- •Задача №4
- •Задание для самостоятельной работы
- •Глава 7. Растворы
- •7.1. Основные способы выражения концентрации растворов
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •7.2. Теория электролитической диссоциации
- •7.2.1. Факторы, влияющие на степень диссоциации электролитов
- •Решение.
- •7.2.2. Реакции в растворах электролитов
- •Решение.
- •7.3. Ионное произведение воды. Водородный показатель
- •Решение.
- •Решение.
- •Шкала значений pH
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •7.4.1. Усиление и подавление гидролиза
- •Решение.
- •Задание для самостоятельной работы
- •Глава 8. Окислительно-восстановительные реакции
- •8.1. Окислители и восстановители
- •8.2. Классификация окислительно-восстановительных реакций
- •8.3.2. Метод электронно-ионного баланса
- •Решение.
- •Задание для самостоятельной работы
6.3. Химическое равновесие
Химические реакции бывают необратимыми и обратимыми.
Необратимыми называют реакции, которые протекают только в одном направлении.
К необратимым реакциям относятся реакции обмена, которые сопровождаются образованием осадка, газа или малодис-социирующего вещества (например, Н2О).
Примеры:
BaCl2
K2SO4
![]() BaSO4
2KCl
BaSO4
2KCl
Na2CO3 2HCl 2NaCl CO2 H2O
HCl KOH KCl H2O
Необратимые реакции протекают до конца, т.е до практически полного израсходования одного из реагентов. Выход продукта в таких реакциях близок к 100%.
Обратимыми называют реакции, которые одновременно протекают в двух противоположных направлениях.
Большинство реакций являются обратимыми. Такие реакции не протекают до конца и характеризуются выходом продукта, который всегда <100%. При записи подобных реакций вместо знака равенства пользуются противоположно направленными стрелками.
Примеры:
N2 3H2 ⇄ 2NH3
H2 I2 ⇄ 2HI
2NO O2 ⇄ 2NO2
С течением времени концентрации реагентов снижаются, а концентрации продуктов, наоборот, увеличиваются. Таким образом согласно закону действующих масс скорость прямой реакции уменьшается, а обратной увеличивается (рис. 6.).
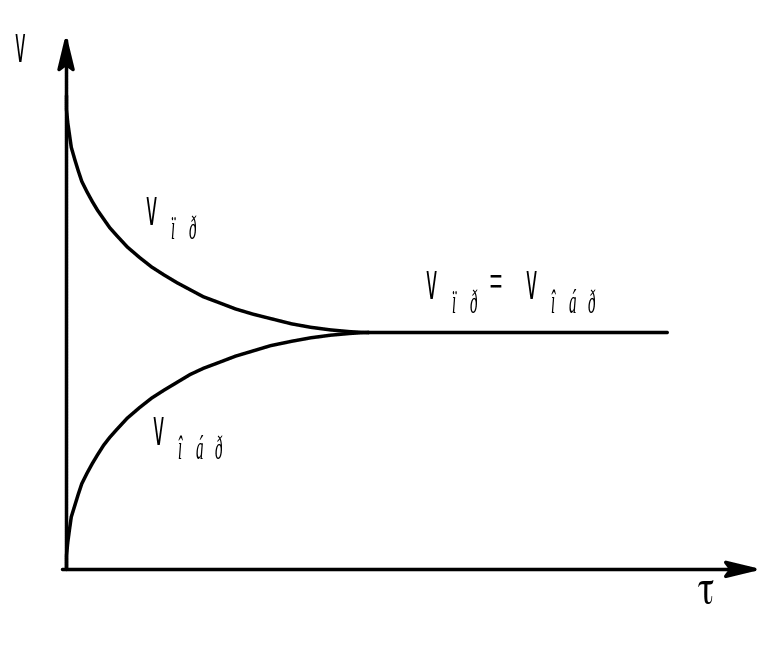
Рис. 6. Зависимость скоростей прямой и обратной реакций от времени.
Как только скорости обеих реакций становятся одинаковыми, в системе устанавливается динамическое равновесие и дальнейшее изменение концентрации всех участвующих в реакции веществ прекращается.
Для гомогенной реакции:
aA bB ⇄ cC dD,
скорость
прямой реакции:
![]()
скорость
обратной реакции:
![]()
В состоянии химического равновесия мы имеем:
![]()
Данное соотношение можно преобразовать следующим образом:
|
(18) |
Величина Kс – константа химического равновесия, заменяющая собой отношение двух постоянных величин kпр. и kобр.. Данная связь константы равновесия с равновесными концентрациями представляет собой выражение закона действующих масс для равновесных систем.
В случае гетерогенных реакций в выражение константы химического равновесия, так же, как и в выражение закона действующих масс для скорости химической реакции, не входят концентрации веществ, находящихся в твердой фазе.
Например:
3Fe(тв.) 4H2O(пар) ⇄ Fe3O4(тв.) 4H2(газ),
![]()
Отметим основные свойства константы равновесия:
1. Численное значение константы равновесия зависит от природы реагирующих веществ и от температуры, но не зависит от концентраций реагентов (парциальных давлений для газофазных реакций) и наличия катализатора.
2. Величина K никогда не бывает равной нулю или бесконечности, т.е., для любой реакции выход отличается от нуля, хотя положение равновесия может быть сильно сдвинуто в любую сторону.
6.3.1. Смещение химического равновесия. Принцип Ле Шателье
Химическое равновесие всегда отвечает определенным условиям. При изменении внешних параметров (температуры, концентрации, в некоторых случаях – давления) равновесие может нарушиться. Это объясняется тем, что изменение условий неодинаково влияет на скорости прямой и обратной реакций. Через некоторое время эти скорости вновь сравниваются (за счет изменения равновесных концентраций) и наступает состояние равновесия, отвечающее новым условиям. Изменение равновесных концентраций реагирующих веществ, вызванное изменением какого-либо параметра системы, называется смещением, или сдвигом, химического равновесия.
Определить направление смещения химического равновесия при изменении одного из параметров можно при помощи принципа Ле Шателье:
Если на систему, находящуюся в состоянии химического равновесия, оказано внешнее воздействие, то равновесие сместится в направлении той реакции, которая ослабляет это воздействие.