
- •Глава 1. Основные понятия химии
- •1.1. Составление химических формул веществ. Понятие о валентности и степени окисления
- •Задание для самостоятельной работы
- •1.2. Химические уравнения
- •1.3. Классификация химических реакций
- •Глава 2. Основные классы неорганических соединений
- •2.1. Оксиды
- •2.1.1. Получение оксидов
- •2.1.2. Классификация и свойства оксидов
- •I. Оксиды металлов.
- •1. Оснóвные оксиды.
- •2. Кислотные оксиды.
- •3. Амфотерные оксиды.
- •II. Оксиды неметаллов.
- •2.2. Гидроксиды
- •I. Гидроксиды металлов.
- •2.2.1. Получение гидроксидов металлов
- •1. Оснóвные гидроксиды.
- •2. Кислотные гидроксиды.
- •3. Амфотерные гидроксиды.
- •II. Гидроксиды неметаллов.
- •2.2.2. Получение кислот
- •2.3. Соли
- •2.3.1. Классификация солей
- •1. Средние (нормальные) соли.
- •2. Кислые соли.
- •3. Оснóвные соли.
- •4. Комплексные соли.
- •5. Двойные соли.
- •6. Смешанные соли.
- •7. Гидратные соли (кристаллогидраты).
- •2.3.2. Физические свойства солей
- •2.3.3. Химические свойства солей
- •Задание для самостоятельной работы
- •Глава 3. Основные законы химии
- •3.1. Международная система единиц (система си)
- •3.2. Атомные и молекулярные массы
- •1. Атомная (или молекулярная) масса m0.
- •2. Относительная атомная (или молекулярная) масса Ar (Mr).
- •3. Молярная масса вещества m.
- •1. Закон сохранения массы веществ.
- •2. Закон постоянства состава.
- •3. Закон стехиометрических соотношений.
- •3.4. Газовые законы
- •Решение.
- •Глава 4. Строение Атома
- •Решение.
- •4.1. Строение электронных оболочек атомов
- •4.2. Электронные конфигурации атомов
- •1. Принцип Паули.
- •2. Правило Хунда.
- •3. Принцип наименьшей энергии.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •4.3. Периодический закон д.И.Менделеева
- •Задание для самостоятельной работы
- •Глава 5. Химическая связь
- •5.1. Ковалентная связь
- •1. Обменный механизм.
- •2. Донорно-акцепторный механизм.
- •5.2. Ионная связь
- •5.3. Металлическая связь
- •5.4. Водородная связь
- •Решение.
- •Задание для самостоятельной работы
- •Глава 6. Физико-химические основы протекания химических реакций
- •6.1. Основы химической термодинамики
- •6.1.1. Термохимические уравнения и расчеты
- •I следствие:
- •Решение.
- •II следствие:
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.2. Скорость химических реакций
- •6.2.1. Основы химической кинетики
- •Решение.
- •1. Зависимость скорости реакции от концентраций реагентов.
- •Решение.
- •Решение.
- •Решение.
- •2. Зависимость скорости реакции от температуры.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.3. Химическое равновесие
- •6.3.1. Смещение химического равновесия. Принцип Ле Шателье
- •1. Влияние изменения концентрации.
- •2. Влияние температуры.
- •2. Влияние давления.
- •Решение.
- •Задача №3
- •Задача №4
- •Задание для самостоятельной работы
- •Глава 7. Растворы
- •7.1. Основные способы выражения концентрации растворов
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •7.2. Теория электролитической диссоциации
- •7.2.1. Факторы, влияющие на степень диссоциации электролитов
- •Решение.
- •7.2.2. Реакции в растворах электролитов
- •Решение.
- •7.3. Ионное произведение воды. Водородный показатель
- •Решение.
- •Решение.
- •Шкала значений pH
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •7.4.1. Усиление и подавление гидролиза
- •Решение.
- •Задание для самостоятельной работы
- •Глава 8. Окислительно-восстановительные реакции
- •8.1. Окислители и восстановители
- •8.2. Классификация окислительно-восстановительных реакций
- •8.3.2. Метод электронно-ионного баланса
- •Решение.
- •Задание для самостоятельной работы
Задача №3
При некоторой температуре в системе 2СO + O2 ⇄ 2СO2 равновесные концентрации СO2 и СO были равны соответственно 0,05 и 0,04 моль/л. Определить исходные концентрации реагентов и выход СO2 (в %), если Kc = 2,5.
Решение.
Исходные концентрации веществ равны:
С0(СO) [СO] С(СO)прореаг.;
С0(O2) [O2] С(O2)прореаг..
Концентрации прореагировавших веществ найдем из стехио-метрических соотношений:
С(СO)прореаг. [СO2] 0,05 моль/л;
С(O2)прореаг.
![]()
0,025 моль/л.
0,025 моль/л.
Равновесную концентрацию O2 найдем из выражения для константы равновесия:
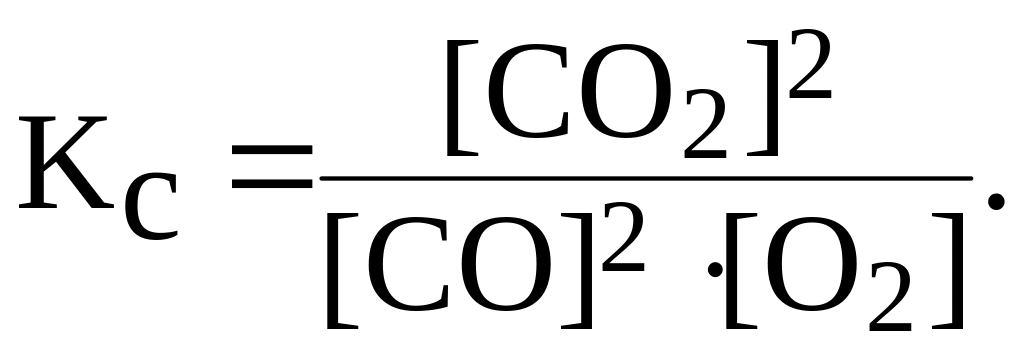
Отсюда:
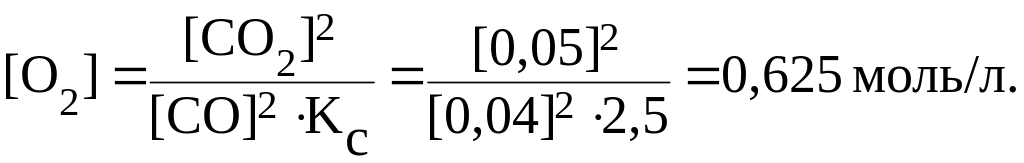
Таким образом:
С0(СO) 0,04 0,05 = 0,09 моль/л;
С0(O2) 0,625 0,025 = 0,65 моль/л.
Теоретический выход СO2 составляет 0,09 моль/л, практический равен 0,05 моль/л. Отсюда:
![]()
Задача №4
Для реакции CO2(газ) H2(газ) ⇄ CO(газ) H2O(пар) константа равновесия равна 1. Исходные концентрации веществ составили: С0(СO2) = 0,2 моль/л; С0(H2) = 0,8 моль/л. Рассчитать, при каких концентрациях всех четырех веществ установилось равновесие.
Решение.
Обозначим концентрации С(СО2) и С(Н2), вступивших в реакцию, через «х», т. е.
С(СO2)прореаг. С(H2)прореаг. х моль/л.
Тогда:
С(СO2)равн. С0(CO2) С(СO2)прореаг. 0,2 х;
С(H2)равн. С0(H2) С(H2)прореаг. 0,8 х.
Из уравнения реакции видно, что:
[СO2] [H2O] x.
Выражение для константы равновесия имеет вид:
![]()
x2 0,16 0,2x 0,8x x2
x 0,16.
Таким образом, равновесные концентрации всех веществ равны:
[СO2] 0,2 0,16 0,04 моль/л;
[H2] 0,8 0,16 0,64 моль/л;
[СO] [H2O] 0,16 моль/л.
Задание для самостоятельной работы
1. Определить направление смещения химического равновесия в обратимой реакции:
H2(газ)
Cl2(газ)
⇄
2HCl(газ)
![]()
при повышении:
а) концентрации водорода;
б) температуры:
в) давления.
2. Реакция взаимодействия азота с водородом обратима: N2 3H2 ⇄ 2NH3. В состоянии равновесия концентрации участвующих в реакции веществ составляют: С(N2) 0,8 моль/л; С(H2) 4,8 моль/л; С(NH3) 0,6 моль/л. Вычислить константу равновесия и исходные концентрации азота и водорода.
3. Константа равновесия для реакции: CH4 Cl2 ⇄ CH3Cl HCl при 800С равна 1. Исходные концентрации взятых веществ составляли: С(CH4) 2 моль/л; С(Cl2) 6 моль/л. Рассчитать, при каких концентрациях всех четырех веществ установилось равновесие.
4. Реакция протекает по уравнению: H2 I2 ⇄ 2HI. Рассчитать константу химического равновесия, если в реакцию вступило 30% I2. Начальные концентрации веществ равны: С(H2) 3 моль/л; С(I2) 6 моль/л.
Глава 7. Растворы
Растворы это гомогенные системы переменного состава, состоящие из двух и более веществ, называемых компонентами.
По агрегатному состоянию растворы могут быть газообразными (воздух), жидкими (кровь, лимфа) и твердыми (сплавы). В медицине наибольшее значение имеют жидкие растворы, которые играют исключительную роль в жизнедеятельности живых организмов. С образованием растворов связаны процессы усвоения пищи и выведения из организма продуктов жизнедеятельности. В форме растворов вводится большое количество лекарственных препаратов.
Для качественного и количественного описания жидких растворов используются термины «растворитель» и «растворенное вещество». В качестве растворителя обычно рассматривают компонент, преобладающий в массовом (или объемном) отношении. Растворители разделяют на полярные (вода, спирты, кислоты) и неполярные (гексан, бензол).
Важнейшим растворителем (а в случае биологических систем – единственным) является вода. Это обусловлено такими свойствами воды, как полярность, низкая вязкость, склонность молекул к ассоциации и др.
Процесс растворения в равной степени зависит как от природы растворителя, так и от свойств растворенного вещества. Очевидно, что способность образовывать растворы выражена у разных веществ по-разному. Одни вещества могут смешиваться друг с другом в любых количествах (вода и этанол), другие – в ограниченных (вода и фенол).
Склонность вещества растворяться в том или ином растворителе можно определить, используя простое эмпирическое правило: подобное растворяется в подобном. Действительно, вещества с ионным (соли, щелочи) или полярным (спирты, альдегиды) типом связи хорошо растворимы в полярных растворителях, например, в воде. И наоборот, растворимость кислорода в бензоле на порядок выше чем в воде, так как молекулы O2 и C6H6 неполярны.
Степень сродства соединения к определенному типу растворителя можно оценить, анализируя природу и количественное соотношение входящих в его состав функциональных групп, среди которых выделяют гидрофильные (притягивающие воду) и гидрофобные (отталкивающие воду). К гидрофильным относят полярные группы, такие как гидроксильная (OH), карбоксильная (COOH), тиольная (SH), амино (NH2). Гидрофобными считают неполярные группы: углеводородные радикалы алифатического (CH3, C2H5) и ароматического (C6H5) рядов. Соединения, имеющие в своем составе как гидрофильные, так и гидрофобные группы, называют дифильными. К таким соединениям относят аминокислоты, белки, нуклеиновые кислоты.
