
- •Глава 1. Основные понятия химии
- •1.1. Составление химических формул веществ. Понятие о валентности и степени окисления
- •Задание для самостоятельной работы
- •1.2. Химические уравнения
- •1.3. Классификация химических реакций
- •Глава 2. Основные классы неорганических соединений
- •2.1. Оксиды
- •2.1.1. Получение оксидов
- •2.1.2. Классификация и свойства оксидов
- •I. Оксиды металлов.
- •1. Оснóвные оксиды.
- •2. Кислотные оксиды.
- •3. Амфотерные оксиды.
- •II. Оксиды неметаллов.
- •2.2. Гидроксиды
- •I. Гидроксиды металлов.
- •2.2.1. Получение гидроксидов металлов
- •1. Оснóвные гидроксиды.
- •2. Кислотные гидроксиды.
- •3. Амфотерные гидроксиды.
- •II. Гидроксиды неметаллов.
- •2.2.2. Получение кислот
- •2.3. Соли
- •2.3.1. Классификация солей
- •1. Средние (нормальные) соли.
- •2. Кислые соли.
- •3. Оснóвные соли.
- •4. Комплексные соли.
- •5. Двойные соли.
- •6. Смешанные соли.
- •7. Гидратные соли (кристаллогидраты).
- •2.3.2. Физические свойства солей
- •2.3.3. Химические свойства солей
- •Задание для самостоятельной работы
- •Глава 3. Основные законы химии
- •3.1. Международная система единиц (система си)
- •3.2. Атомные и молекулярные массы
- •1. Атомная (или молекулярная) масса m0.
- •2. Относительная атомная (или молекулярная) масса Ar (Mr).
- •3. Молярная масса вещества m.
- •1. Закон сохранения массы веществ.
- •2. Закон постоянства состава.
- •3. Закон стехиометрических соотношений.
- •3.4. Газовые законы
- •Решение.
- •Глава 4. Строение Атома
- •Решение.
- •4.1. Строение электронных оболочек атомов
- •4.2. Электронные конфигурации атомов
- •1. Принцип Паули.
- •2. Правило Хунда.
- •3. Принцип наименьшей энергии.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •4.3. Периодический закон д.И.Менделеева
- •Задание для самостоятельной работы
- •Глава 5. Химическая связь
- •5.1. Ковалентная связь
- •1. Обменный механизм.
- •2. Донорно-акцепторный механизм.
- •5.2. Ионная связь
- •5.3. Металлическая связь
- •5.4. Водородная связь
- •Решение.
- •Задание для самостоятельной работы
- •Глава 6. Физико-химические основы протекания химических реакций
- •6.1. Основы химической термодинамики
- •6.1.1. Термохимические уравнения и расчеты
- •I следствие:
- •Решение.
- •II следствие:
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.2. Скорость химических реакций
- •6.2.1. Основы химической кинетики
- •Решение.
- •1. Зависимость скорости реакции от концентраций реагентов.
- •Решение.
- •Решение.
- •Решение.
- •2. Зависимость скорости реакции от температуры.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.3. Химическое равновесие
- •6.3.1. Смещение химического равновесия. Принцип Ле Шателье
- •1. Влияние изменения концентрации.
- •2. Влияние температуры.
- •2. Влияние давления.
- •Решение.
- •Задача №3
- •Задача №4
- •Задание для самостоятельной работы
- •Глава 7. Растворы
- •7.1. Основные способы выражения концентрации растворов
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •7.2. Теория электролитической диссоциации
- •7.2.1. Факторы, влияющие на степень диссоциации электролитов
- •Решение.
- •7.2.2. Реакции в растворах электролитов
- •Решение.
- •7.3. Ионное произведение воды. Водородный показатель
- •Решение.
- •Решение.
- •Шкала значений pH
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •7.4.1. Усиление и подавление гидролиза
- •Решение.
- •Задание для самостоятельной работы
- •Глава 8. Окислительно-восстановительные реакции
- •8.1. Окислители и восстановители
- •8.2. Классификация окислительно-восстановительных реакций
- •8.3.2. Метод электронно-ионного баланса
- •Решение.
- •Задание для самостоятельной работы
7.3. Ионное произведение воды. Водородный показатель
Вода относится к очень слабым амфотерным электролитам. Чистая вода в незначительной степени диссоциирует на ионы:
H2O ⇄ Н+ ОН.
Применяя закон действующих масс, можно написать:
|
(29) |
Так как степень
диссоциации воды незначительная, то
[Н2О] >> [Н+][ОН]
и равновесную концентрацию
недиссоциирован-ных молекул воды [Н2О]
можно считать постоянной и объединить
ее с
![]() (H2O)
в одну величину
(H2O)
в одну величину
![]() :
:
|
(30) |
Константу KW, равную произведению концентраций ионов Н+ и ОН, называют ионным произведением воды.
Величина
![]() постоянна только при данной температуре.
При увеличении температуры степень
диссоциации воды возрастает (диссоциация
воды ‑ процесс эндотермический), что
приводит к повышению концентраций ионов
Н+
и ОН.
Следовательно, повышение температуры
увеличивает значение
:
при изменении температуры от 0 до 1000С
оно возрастает приблизительно в 300 раз.
постоянна только при данной температуре.
При увеличении температуры степень
диссоциации воды возрастает (диссоциация
воды ‑ процесс эндотермический), что
приводит к повышению концентраций ионов
Н+
и ОН.
Следовательно, повышение температуры
увеличивает значение
:
при изменении температуры от 0 до 1000С
оно возрастает приблизительно в 300 раз.
(H2O)
была
определена методом электропроводности
и при 220С
ее величина составила 1,81016.
Этим же методом было установлено, что
в одном литре воды (1000 г) на ионы
диссоциирует 107
моль воды. Таким образом, из 55,6 моль
![]() ,
содержащихся в 1 л воды, только 107
моль находятся в диссоциированном
состоянии. Следовательно:
,
содержащихся в 1 л воды, только 107
моль находятся в диссоциированном
состоянии. Следовательно:
![]()
![]()
|
(31) |
Таким образом, при температуре 20-250С ионное произведение воды 1014, а показатель ионного произведения воды pKW 14 (pKW lgKW lg1014 14).
Так как в чистой воде и в разбавленных водных растворах кислот, оснований и солей величина KW постоянная, то концентрации ионов Н+ и ОН являются величинами сопряженными, т. е. зависящими друг от друга.
Например, если в растворе при 20-250С [Н+] 103 моль/л, то в этом же растворе:
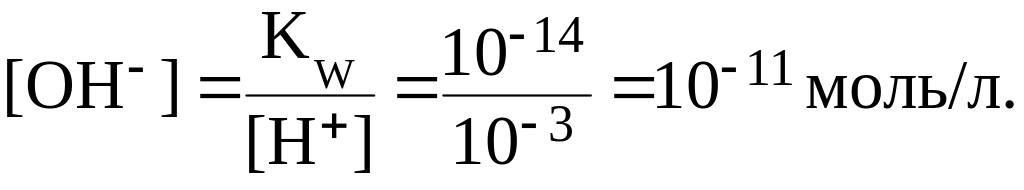
В чистой воде при диссоциации ее молекул образуется одинаковое количество ионов Н+ и ОН, следовательно, при 20-250С:
[H+] [OH] 107 моль/л.
В водных растворах различных соединений в зависимости от соотношения концентраций ионов Н+ и ОН– реакция среды может быть:
нейтральная:
[H+] [OH] 107 моль/л;
кислая:
[H+] > [OH],
[H+] > 107 моль/л; [OH] < 107 моль/л;
щелочная:
[H+] < [OH],
[H+] < 107 моль/л; [OH] > 107 моль/л.
На практике наиболее важное значение имеет активная реакция среды, определяемая активностью (концентрацией) ионов Н+ (активная кислотность) или ионов ОН, содержащихся в данной среде (активная щелочность).
Активную кислотность принято характеризовать отрицательным десятичным логарифмом концентрации ионов водорода водородным показателем (рН):
|
(32) |
Водородный показатель (рН) количественная характеристика активной кислотности.
Для количественной характеристики активной щелочности применяют гидроксидный показатель (рОН):
|
(33) |
Если выражение KW [Н+][ОН] прологарифмировать (записать отрицательный десятичный логарифм левой и правой части), то получим:
![]() ,
,
иначе говоря:
|
(34) |
Так как при t0 = 20-250С pKW 14 (KW 1014), то при этой температуре:
pH pOH 14 |
(35) |
При помощи водородного показателя удобно выражать характер среды:
нейтральная среда: рН 7 (рН рОН),
кислая среда: рН < 7 (рН < рОН),
щелочная среда рН > 7 (рН > рОН).
Таким образом, увеличение концентрации ионов Н+ уменьшает рН (величина рОН при этом возрастает), а уменьшение концентрации ионов Н+ увеличивает рН (величина рОН при этом уменьшается). При сопоставлении значений pН разных растворов следует относить эти значения к одной и той же температуре.
Пример 1. Желудочный сок, плазма крови и слюна в норме характеризуются значениями pH, равными соответственно 0,9-2,5; 7,4 0,5; 6,35-6,85. Определить характер среды этих биологических жидкостей.

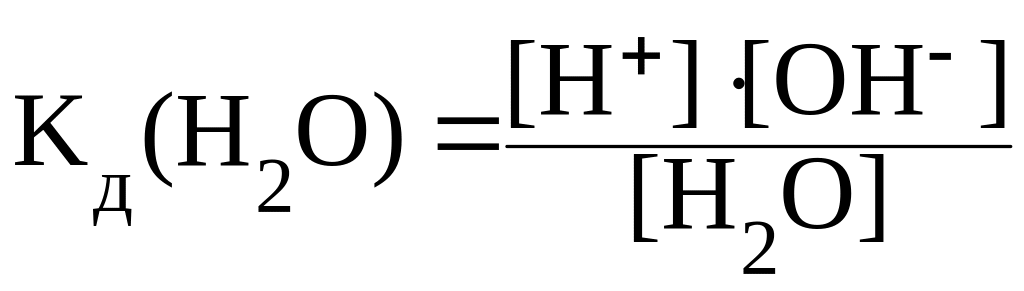 .
.