
- •Глава 1. Основные понятия химии
- •1.1. Составление химических формул веществ. Понятие о валентности и степени окисления
- •Задание для самостоятельной работы
- •1.2. Химические уравнения
- •1.3. Классификация химических реакций
- •Глава 2. Основные классы неорганических соединений
- •2.1. Оксиды
- •2.1.1. Получение оксидов
- •2.1.2. Классификация и свойства оксидов
- •I. Оксиды металлов.
- •1. Оснóвные оксиды.
- •2. Кислотные оксиды.
- •3. Амфотерные оксиды.
- •II. Оксиды неметаллов.
- •2.2. Гидроксиды
- •I. Гидроксиды металлов.
- •2.2.1. Получение гидроксидов металлов
- •1. Оснóвные гидроксиды.
- •2. Кислотные гидроксиды.
- •3. Амфотерные гидроксиды.
- •II. Гидроксиды неметаллов.
- •2.2.2. Получение кислот
- •2.3. Соли
- •2.3.1. Классификация солей
- •1. Средние (нормальные) соли.
- •2. Кислые соли.
- •3. Оснóвные соли.
- •4. Комплексные соли.
- •5. Двойные соли.
- •6. Смешанные соли.
- •7. Гидратные соли (кристаллогидраты).
- •2.3.2. Физические свойства солей
- •2.3.3. Химические свойства солей
- •Задание для самостоятельной работы
- •Глава 3. Основные законы химии
- •3.1. Международная система единиц (система си)
- •3.2. Атомные и молекулярные массы
- •1. Атомная (или молекулярная) масса m0.
- •2. Относительная атомная (или молекулярная) масса Ar (Mr).
- •3. Молярная масса вещества m.
- •1. Закон сохранения массы веществ.
- •2. Закон постоянства состава.
- •3. Закон стехиометрических соотношений.
- •3.4. Газовые законы
- •Решение.
- •Глава 4. Строение Атома
- •Решение.
- •4.1. Строение электронных оболочек атомов
- •4.2. Электронные конфигурации атомов
- •1. Принцип Паули.
- •2. Правило Хунда.
- •3. Принцип наименьшей энергии.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •4.3. Периодический закон д.И.Менделеева
- •Задание для самостоятельной работы
- •Глава 5. Химическая связь
- •5.1. Ковалентная связь
- •1. Обменный механизм.
- •2. Донорно-акцепторный механизм.
- •5.2. Ионная связь
- •5.3. Металлическая связь
- •5.4. Водородная связь
- •Решение.
- •Задание для самостоятельной работы
- •Глава 6. Физико-химические основы протекания химических реакций
- •6.1. Основы химической термодинамики
- •6.1.1. Термохимические уравнения и расчеты
- •I следствие:
- •Решение.
- •II следствие:
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.2. Скорость химических реакций
- •6.2.1. Основы химической кинетики
- •Решение.
- •1. Зависимость скорости реакции от концентраций реагентов.
- •Решение.
- •Решение.
- •Решение.
- •2. Зависимость скорости реакции от температуры.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.3. Химическое равновесие
- •6.3.1. Смещение химического равновесия. Принцип Ле Шателье
- •1. Влияние изменения концентрации.
- •2. Влияние температуры.
- •2. Влияние давления.
- •Решение.
- •Задача №3
- •Задача №4
- •Задание для самостоятельной работы
- •Глава 7. Растворы
- •7.1. Основные способы выражения концентрации растворов
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •7.2. Теория электролитической диссоциации
- •7.2.1. Факторы, влияющие на степень диссоциации электролитов
- •Решение.
- •7.2.2. Реакции в растворах электролитов
- •Решение.
- •7.3. Ионное произведение воды. Водородный показатель
- •Решение.
- •Решение.
- •Шкала значений pH
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •7.4.1. Усиление и подавление гидролиза
- •Решение.
- •Задание для самостоятельной работы
- •Глава 8. Окислительно-восстановительные реакции
- •8.1. Окислители и восстановители
- •8.2. Классификация окислительно-восстановительных реакций
- •8.3.2. Метод электронно-ионного баланса
- •Решение.
- •Задание для самостоятельной работы
5.3. Металлическая связь
Особый тип решетки в твердом состоянии образуют металлы. В узлах такой металлической кристаллической решетки находятся катионы металлов, а между ними – отрицательно заряженный «электронный газ». Атомы металлов в решетке упакованы так тесно, что валентные орбитали соседних атомов перекрываются, и электроны получают возможность свободно перемещаться из орбиталей одного атома в орбитали других атомов, осуществляя связь между всеми атомами данного кристалла металла. Лишенные валентных электронов, атомы превращаются в катионы, а электроны, осуществляющие связь, перемещаются по всему кристаллу металла и становятся общими.
Химическая связь, которая осуществляется электронами, принадлежащими всем атомам одновременно, называется металлической связью.
Металлическая связь характерна для металлов в твердом и жидком состоянии и имеет некоторое сходство с ковалентной, поскольку в ее основе также лежит обобществление валентных электронов. Однако при образовании ковалентной связи эти электроны находятся вблизи соединенных атомов и прочно с ними связаны, тогда как при металлической связи электроны свободно перемещаются по всему кристаллу и принадлежат всем его атомам. Именно поэтому кристаллы с ковалентной связью хрупки, а с металлической пластичны, т.е. без разрушения изменяют форму, прокатываются в листы, вытягиваются в проволоку. Наличие свободных электронов придает кристаллам металлов непрозрачность, высокую электрическую проводимость, теплопроводность.
5.4. Водородная связь
В некоторых случаях происходит образование особой формы химической связи, называемой водородной связью. Она менее прочна, чем уже рассмотренные виды, и может считаться дополнительной связью к уже существующим ковалентным связям.
Водородная связь возникает между атомом водорода в соединении и сильно электроотрицательным элементом с малыми размерами фтором, кислородом, азотом, иногда с хлором и серой. Водородную связь обозначают тремя точками , подчеркивая тем самым ее сравнительную слабость (примерно в 15-20 раз слабее ковалентной).
Например, атомы водорода и кислорода в соседних молекулах воды связаны между собой водородной связью:
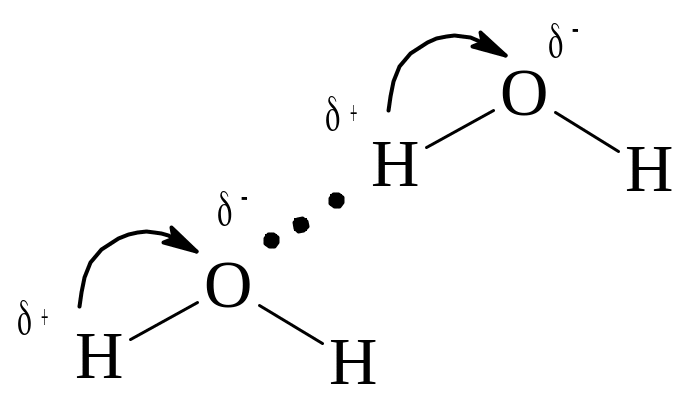
Общая электронная пара, образующая связь Н О, сильно смещена от атома Н в сторону значительно более электроотрицательного атома О. Положительный заряд, возникающий на атоме Н, сконцентрирован в малом объеме и может взаимодействовать с неподеленной электронной парой атома О соседней молекулы. Однако водородную связь нельзя сводить только к электростатическому притяжению. Более правильно считать, что в образование водородной связи вносит существенный вклад донорно-акцепторное взаимодействие между неподеленной парой атома О соседней молекулы воды и полупустой орбиталью атома Н, из которой единственный электрон сильно смещен в сторону атома О. В пользу этого механизма говорит тот факт, что для водородной связи, как и для ковалентной, характерны направленность в пространстве и насыщаемость.
Несмотря на сравнительную непрочность водородных связей, их присутствие сказывается как на физических, так и на химических свойствах веществ. В частности, она отвечает за ассоциацию молекул. Наличием водородных связей объясняется более высокая температура кипения воды по сравнению с аналогичными водородными соединениями других элементов подгруппы кислорода серы, селена и теллура (Н2S, H2Se, H2Te), которые в силу большего радиуса атома (S, Se, Te) не образуют водородных связей. Если бы не было водородных связей между молекулами воды, вода имела бы температуру плавления около 1000C и температуру кипения около 800C. Повышенные температуры плавления и кипения объясняются необходимостью затраты дополнительной энергии на разрушение водородных связей. В твердом состоянии (в виде льда) молекулы воды связаны между собой большим количеством водородных связей, поэтому образуется далекая от плотной упаковки структура; при переходе в жидкое состояние часть связей разрушается, что сближает молекулы, поэтому вода немного плотнее льда.
Пример 1. Определите, какие химические связи присутствуют в молекуле серной кислоты, сравните их прочность, укажите валентность и степень окисления атома серы.
