
- •Глава 1. Основные понятия химии
- •1.1. Составление химических формул веществ. Понятие о валентности и степени окисления
- •Задание для самостоятельной работы
- •1.2. Химические уравнения
- •1.3. Классификация химических реакций
- •Глава 2. Основные классы неорганических соединений
- •2.1. Оксиды
- •2.1.1. Получение оксидов
- •2.1.2. Классификация и свойства оксидов
- •I. Оксиды металлов.
- •1. Оснóвные оксиды.
- •2. Кислотные оксиды.
- •3. Амфотерные оксиды.
- •II. Оксиды неметаллов.
- •2.2. Гидроксиды
- •I. Гидроксиды металлов.
- •2.2.1. Получение гидроксидов металлов
- •1. Оснóвные гидроксиды.
- •2. Кислотные гидроксиды.
- •3. Амфотерные гидроксиды.
- •II. Гидроксиды неметаллов.
- •2.2.2. Получение кислот
- •2.3. Соли
- •2.3.1. Классификация солей
- •1. Средние (нормальные) соли.
- •2. Кислые соли.
- •3. Оснóвные соли.
- •4. Комплексные соли.
- •5. Двойные соли.
- •6. Смешанные соли.
- •7. Гидратные соли (кристаллогидраты).
- •2.3.2. Физические свойства солей
- •2.3.3. Химические свойства солей
- •Задание для самостоятельной работы
- •Глава 3. Основные законы химии
- •3.1. Международная система единиц (система си)
- •3.2. Атомные и молекулярные массы
- •1. Атомная (или молекулярная) масса m0.
- •2. Относительная атомная (или молекулярная) масса Ar (Mr).
- •3. Молярная масса вещества m.
- •1. Закон сохранения массы веществ.
- •2. Закон постоянства состава.
- •3. Закон стехиометрических соотношений.
- •3.4. Газовые законы
- •Решение.
- •Глава 4. Строение Атома
- •Решение.
- •4.1. Строение электронных оболочек атомов
- •4.2. Электронные конфигурации атомов
- •1. Принцип Паули.
- •2. Правило Хунда.
- •3. Принцип наименьшей энергии.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •4.3. Периодический закон д.И.Менделеева
- •Задание для самостоятельной работы
- •Глава 5. Химическая связь
- •5.1. Ковалентная связь
- •1. Обменный механизм.
- •2. Донорно-акцепторный механизм.
- •5.2. Ионная связь
- •5.3. Металлическая связь
- •5.4. Водородная связь
- •Решение.
- •Задание для самостоятельной работы
- •Глава 6. Физико-химические основы протекания химических реакций
- •6.1. Основы химической термодинамики
- •6.1.1. Термохимические уравнения и расчеты
- •I следствие:
- •Решение.
- •II следствие:
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.2. Скорость химических реакций
- •6.2.1. Основы химической кинетики
- •Решение.
- •1. Зависимость скорости реакции от концентраций реагентов.
- •Решение.
- •Решение.
- •Решение.
- •2. Зависимость скорости реакции от температуры.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.3. Химическое равновесие
- •6.3.1. Смещение химического равновесия. Принцип Ле Шателье
- •1. Влияние изменения концентрации.
- •2. Влияние температуры.
- •2. Влияние давления.
- •Решение.
- •Задача №3
- •Задача №4
- •Задание для самостоятельной работы
- •Глава 7. Растворы
- •7.1. Основные способы выражения концентрации растворов
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •7.2. Теория электролитической диссоциации
- •7.2.1. Факторы, влияющие на степень диссоциации электролитов
- •Решение.
- •7.2.2. Реакции в растворах электролитов
- •Решение.
- •7.3. Ионное произведение воды. Водородный показатель
- •Решение.
- •Решение.
- •Шкала значений pH
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •7.4.1. Усиление и подавление гидролиза
- •Решение.
- •Задание для самостоятельной работы
- •Глава 8. Окислительно-восстановительные реакции
- •8.1. Окислители и восстановители
- •8.2. Классификация окислительно-восстановительных реакций
- •8.3.2. Метод электронно-ионного баланса
- •Решение.
- •Задание для самостоятельной работы
Задание для самостоятельной работы
1. Составить формулы оксидов K, Ca, Mg, Al, Pb(II), Fe(II), Fe(III), Cl(V), Cl(VII), Mn(VI).
2. Составить формулы солей, образованных кислотами HNO3, H2S, H3PO4 и металлами Ba, K, Cr(III), Zn, Ag.
1.2. Химические уравнения
Превращения веществ, сопровождающиеся изменением их состава и (или) строения, называются химическими реакциями.
Химические реакции записывают посредством химических уравнений или схем, в которых вещества записывают при помощи химических формул.
Схема химической реакции отражает только суть происходящих превращений. В левой части пишут формулы веществ, вступающих в реакцию, в правой формулы веществ, образующихся в результате реакции. Так, процесс окисления толуола можно отразить схемой:
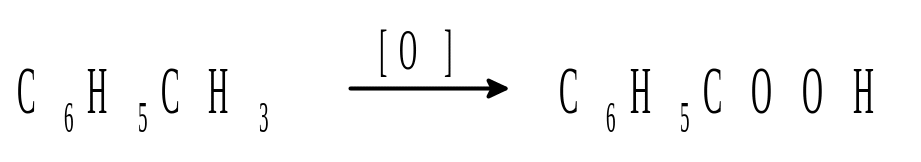
В химических уравнениях, в отличие от схем, число атомов каждого элемента должно быть одинаково в левой и в правой части уравнения. Например, уравнение реакции окисления толуола перманганатом калия в кислой среде выглядит так:
5C6H5CH3 + 6KMnO4 + 9H2SO4 = 5C6H5COOH + 6MnSO4 + 3K2SO4 + 14H2O
Коэффициенты перед формулами веществ в химических уравнениях называют стехиометрическими коэффициентами.
Если в результате реакции образуются осадок или газ, то это отражается вертикальными стрелками, ↓ или ↑ соответственно:
3Al(NO3)2 + 6KOH = 2Al(OH)3↓ + 6KNO3
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
1.3. Классификация химических реакций
Химические реакции можно классифицировать по различным признакам:
1) по изменению числа и состава исходных веществ и продуктов реакции;
2) по агрегатному состоянию веществ (газовые реакции, реакции в растворах);
3) по физическому (фазовому) состоянию (гомогенные, гетеро-генные);
4) по тепловому эффекту (эндотермические и экзотермические);
5) по возможности протекания в прямом и обратном направлении (обратимые и необратимые).
Наиболее распространенной является классификация по числу и составу продуктов и реагентов. В рамках этой классификации рассматриваются также реакции, которые протекают с изменением степени окисления элементов (окислительно-восстановительные) и без изменения степени окисления элементов.
1) Реакции соединения.
В этих реакциях из более простых веществ (A, B и C) образуются вещества более сложного строения (D):
A + B + C = D.
Э
+4
0
+6
2
2Na2SO3 + O2 = 2Na2SO4,
так и протекать без изменения степени окисления элементов:
CaO + CO2 = CaCO3.
2) Реакции разложения.
В этих реакциях из более сложных веществ образуются более простые:
D = A + B + C.
Э
+5
2
+4
0
t0C
2Cu(NO3)2 = 2CuO + 4NO2 + O2,
т
t0C
Ca(OH)2 = CaO + H2O.
3) Реакции замещения.
Эти реакции протекают по схеме:
AB + C = AC + B
и
+2
+2
0
0
C
1
0
1
0
2KBr + Cl2 = 2KCl + Br2
4) Реакции обмена.
Эти реакции протекают по схеме:
AB + CD = AC + BD
и всегда протекают без изменения степени окисления элементов.
Они могут быть обратимыми:
СH3COONa
+ H2O
![]() СH3COOH
+ NaOH
СH3COOH
+ NaOH
и необратимыми:
AgNO3
+ KBr
![]() AgBr↓ + KNO3
AgBr↓ + KNO3
H2SO4 + 2NaOH Na2SO4 + 2H2O
K2CO3 + 2HCl 2KCl + H2O + CO2↑
Реакции обмена протекают необратимо, если в результате реакции образуется газ, вода или малорастворимое соединение.
