
- •Глава 1. Основные понятия химии
- •1.1. Составление химических формул веществ. Понятие о валентности и степени окисления
- •Задание для самостоятельной работы
- •1.2. Химические уравнения
- •1.3. Классификация химических реакций
- •Глава 2. Основные классы неорганических соединений
- •2.1. Оксиды
- •2.1.1. Получение оксидов
- •2.1.2. Классификация и свойства оксидов
- •I. Оксиды металлов.
- •1. Оснóвные оксиды.
- •2. Кислотные оксиды.
- •3. Амфотерные оксиды.
- •II. Оксиды неметаллов.
- •2.2. Гидроксиды
- •I. Гидроксиды металлов.
- •2.2.1. Получение гидроксидов металлов
- •1. Оснóвные гидроксиды.
- •2. Кислотные гидроксиды.
- •3. Амфотерные гидроксиды.
- •II. Гидроксиды неметаллов.
- •2.2.2. Получение кислот
- •2.3. Соли
- •2.3.1. Классификация солей
- •1. Средние (нормальные) соли.
- •2. Кислые соли.
- •3. Оснóвные соли.
- •4. Комплексные соли.
- •5. Двойные соли.
- •6. Смешанные соли.
- •7. Гидратные соли (кристаллогидраты).
- •2.3.2. Физические свойства солей
- •2.3.3. Химические свойства солей
- •Задание для самостоятельной работы
- •Глава 3. Основные законы химии
- •3.1. Международная система единиц (система си)
- •3.2. Атомные и молекулярные массы
- •1. Атомная (или молекулярная) масса m0.
- •2. Относительная атомная (или молекулярная) масса Ar (Mr).
- •3. Молярная масса вещества m.
- •1. Закон сохранения массы веществ.
- •2. Закон постоянства состава.
- •3. Закон стехиометрических соотношений.
- •3.4. Газовые законы
- •Решение.
- •Глава 4. Строение Атома
- •Решение.
- •4.1. Строение электронных оболочек атомов
- •4.2. Электронные конфигурации атомов
- •1. Принцип Паули.
- •2. Правило Хунда.
- •3. Принцип наименьшей энергии.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •4.3. Периодический закон д.И.Менделеева
- •Задание для самостоятельной работы
- •Глава 5. Химическая связь
- •5.1. Ковалентная связь
- •1. Обменный механизм.
- •2. Донорно-акцепторный механизм.
- •5.2. Ионная связь
- •5.3. Металлическая связь
- •5.4. Водородная связь
- •Решение.
- •Задание для самостоятельной работы
- •Глава 6. Физико-химические основы протекания химических реакций
- •6.1. Основы химической термодинамики
- •6.1.1. Термохимические уравнения и расчеты
- •I следствие:
- •Решение.
- •II следствие:
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.2. Скорость химических реакций
- •6.2.1. Основы химической кинетики
- •Решение.
- •1. Зависимость скорости реакции от концентраций реагентов.
- •Решение.
- •Решение.
- •Решение.
- •2. Зависимость скорости реакции от температуры.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.3. Химическое равновесие
- •6.3.1. Смещение химического равновесия. Принцип Ле Шателье
- •1. Влияние изменения концентрации.
- •2. Влияние температуры.
- •2. Влияние давления.
- •Решение.
- •Задача №3
- •Задача №4
- •Задание для самостоятельной работы
- •Глава 7. Растворы
- •7.1. Основные способы выражения концентрации растворов
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •7.2. Теория электролитической диссоциации
- •7.2.1. Факторы, влияющие на степень диссоциации электролитов
- •Решение.
- •7.2.2. Реакции в растворах электролитов
- •Решение.
- •7.3. Ионное произведение воды. Водородный показатель
- •Решение.
- •Решение.
- •Шкала значений pH
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •7.4.1. Усиление и подавление гидролиза
- •Решение.
- •Задание для самостоятельной работы
- •Глава 8. Окислительно-восстановительные реакции
- •8.1. Окислители и восстановители
- •8.2. Классификация окислительно-восстановительных реакций
- •8.3.2. Метод электронно-ионного баланса
- •Решение.
- •Задание для самостоятельной работы
2. Донорно-акцепторный механизм.
В этом случае химическая связь возникает за счет двухэлектронного облака одного атома (спаренных электронов) и свободной орбитали другого атома. Атом, предоставляющий неподеленную пару, называется донором, а атом, принимающий ее (т.е. предоставляющий свободную орбиталь) акцептором.
Механизм образования ковалентной связи за счет двухэлектронного облака одного атома (донора) и свободной орбитали другого атома (акцептора) называется донорно-акцепторным.
Рассмотрим в качестве примера механизм образования иона аммония NH4+. В молекуле аммиака атом азота имеет неподеленную пару электронов, а у иона водорода H+ свободна 1s-орбиталь. При образовании катиона аммония двухэлектронное облако азота становится общим для атомов N и Н, т.е. оно превращается в молекулярное электронное облако. Таким образом, возникает четвертая ковалентная связь:
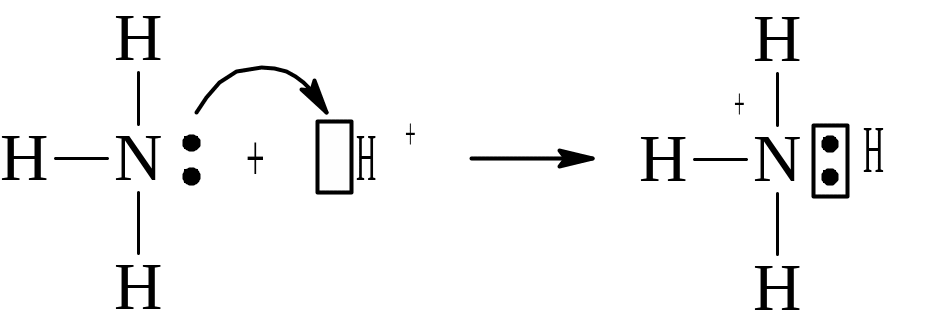
Положительный заряд иона водорода также становится общим (он рассредоточен между всеми атомами).
По своим свойствам четвертая N–H связь в ионе NH4+ ничем не отличается от остальных трех. Поэтому донорно-акцепторная связь это не особый вид связи, а лишь особый механизм (способ) образования ковалентной связи.
Ковалентная связь, образованная по донорно-акцепторному механизму, присутствует в молекулах различных неорганических и органических веществ: аммонийных соединений, комплексных солей и др. Она расширяет возможности образования ковалентных связей атомов, которые лишены неспаренных электронов или уже использовали все неспаренные электроны.
5.2. Ионная связь
Ионная связь возникает в случаях, когда взаимодействуют электронные облака атомов, чьи относительные электро-отрицательности резко отличаются. В этом случае общая электронная пара настолько смещена к одному из атомов, что практически переходит в его владение. При этом он образует отрицательно заряженный ион (анион), а атом, отдавший электрон положительно заряженный ион (катион). Например, атомы натрия и хлора резко отличаются по электроотрицательности (0,9 и 3 соответственно), поэтому атом хлора очень сильно притягивает электрон, стремясь завершить свой внешний электронный уровень, а атом натрия охотно его отдает, поскольку ему для получения устойчивой конфигурации внешнего слоя удобнее отдать единственный валентный электрон:
Na (1s22s22p63s1) ē = Na+ (1s22s22p6)
Cl (1s22s22p63s23p5) + ē = Cl (1s22s22p63s23p6)
Электронная оболочка атома натрия превратилась в устойчивую оболочку атома неона, а оболочка атома хлора в устойчивую оболочку другого инертного газа аргона. Между ионами Na+ и Cl, несущими разноименные заряды, возникают силы электро-статического притяжения, в результате чего образуется соединение NaCl.
Химическая связь между ионами, возникающая в результате их электростатического притяжения, называется ионной связью.
Ионные соединения образуют атомы элементов, резко отличающихся по электроотрицательности, например, атомы элементов главных подгрупп I и II групп с элементами главных подгрупп VI и VII групп.
Между полярностью связи и разностью электроотрицательностей атомов, образующих связь, существует определенная зависимость, которая позволяет предсказать полярность связи в соединении. Чем больше разность относительных электроотрицательностей элементов, тем сильнее выражена полярность связи, которую они образуют. Предельно высокая разность в значениях электроотрицательности элементов имеет место в соединении CsF (x = 4,1 0,86 = 3,24).
В действительности чисто ионных соединений (со степенью ионности связи 100%) не бывает. Даже во фториде цезия степень ионности связи составляет 89%. Считают, что связь между атомами ионная, если степень ионности связи превышает 50%. Этой величине соответствует разность в электроотрицательности 1,7.
Поскольку пар атомов с резко отличающимися значениями относительной электроотрицательности немного, то и число ионных соединений ограничено и большинство молекул образовано ковалентными связями.
Таким образом, между механизмами возникновения ковалентной и ионной связей нет принципиального различия. Они различаются лишь степенью поляризации (смещения) общих электронных пар. Поэтому ионную связь можно рассматривать как предельный случай полярной ковалентной связи.
Вместе с тем надо помнить о важных отличиях ионной связи от ковалентной. Ионная связь характеризуется ненаправленностью в пространстве (каждый ион может притягивать ион противоположного знака по любому направлению) и ненасыщаемостью (взаимодействие ионов не устраняет способность притягивать или отталкивать другие ионы). Вследствие ненаправленности и ненасыщаемости ионные соединения в твердом состоянии представляют собой ионную кристаллическую решетку, в которой каждый ион взаимодействует не с одним, а со многими ионами противоположного знака; например, в решетке хлорида натрия катион натрия окружен шестью хлорид-анионами и наоборот. Связи между ионами многочисленны и прочны, поэтому вещества с ионной решеткой тугоплавки, малолетучи и обладают сравнительно высокой твердостью. При плавлении ионных кристаллов прочность связи между ионами уменьшается, и расплавы их проводят электрический ток. Ионные соединения, как правило, хорошо растворяются в воде и других полярных растворителях.
В то же время ковалентная связь отличается насыщаемостью (т.е. способностью атомов образовывать ограниченное количество ковалентных связей, определяемое числом неспаренных электронов) и направленностью (определенной пространственной структурой молекул, которой мы коснемся ниже). Твердые вещества, состоящие из молекул (полярных и неполярных), образуют молекулярные кристаллические решетки. Молекулы в таких решетках соединены сравнительно слабыми межмолекулярными силами, поэтому вещества с молекулярной решеткой имеют малую твердость, низкие температуры плавления, они плохо растворимы в воде, а их растворы почти не проводят электрический ток. Число неорганических веществ с молекулярной кристаллической решеткой невелико: лед, твердый оксид углерода (IV) («сухой лед»), твердые галогеноводороды и простые вещества, но зато большинство кристаллических органических соединений имеют молекулярную решетку.
Если же в узлах решетки располагаются атомы, соединенные прочными ковалентными связями, то такие вещества имеют высокие температуры плавления, прочность и твердость, они практически нерастворимы в жидкостях. Характерный пример вещества с атомной кристаллической решеткой алмаз; она характерна также для твердого бора, кремния, германия и соединений некоторых элементов с углеродом и кремнием.
