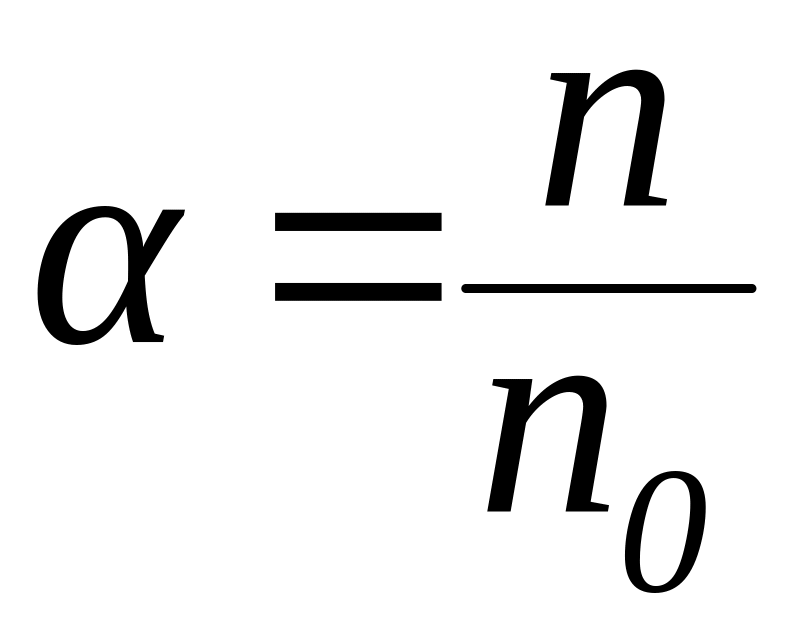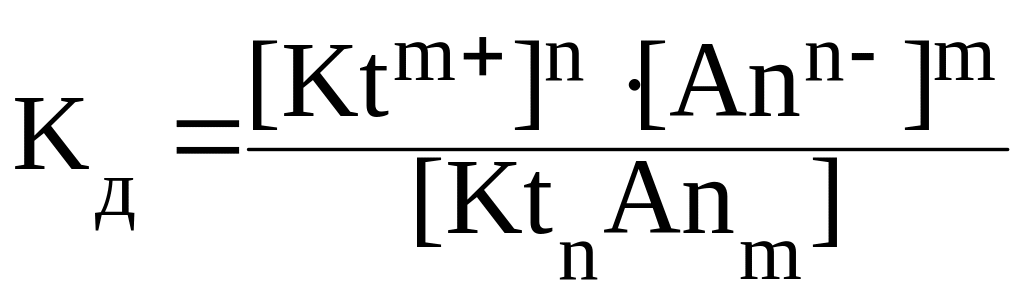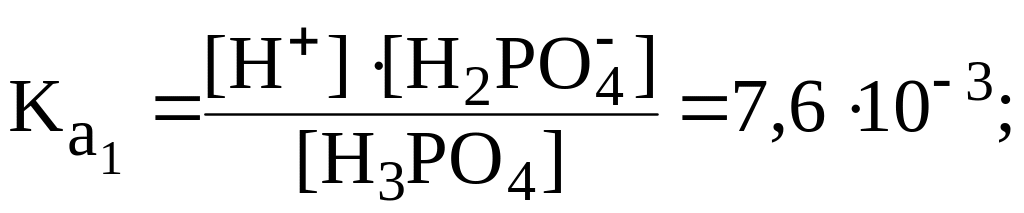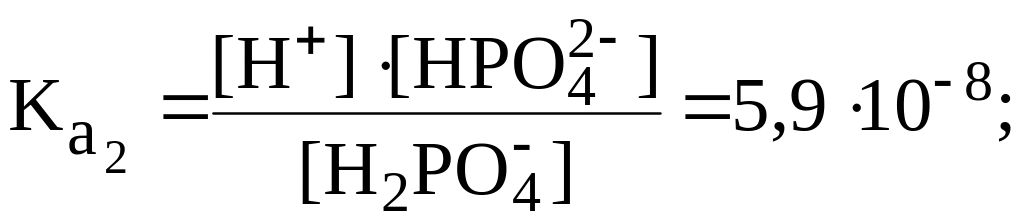- •Глава 1. Основные понятия химии
- •1.1. Составление химических формул веществ. Понятие о валентности и степени окисления
- •Задание для самостоятельной работы
- •1.2. Химические уравнения
- •1.3. Классификация химических реакций
- •Глава 2. Основные классы неорганических соединений
- •2.1. Оксиды
- •2.1.1. Получение оксидов
- •2.1.2. Классификация и свойства оксидов
- •I. Оксиды металлов.
- •1. Оснóвные оксиды.
- •2. Кислотные оксиды.
- •3. Амфотерные оксиды.
- •II. Оксиды неметаллов.
- •2.2. Гидроксиды
- •I. Гидроксиды металлов.
- •2.2.1. Получение гидроксидов металлов
- •1. Оснóвные гидроксиды.
- •2. Кислотные гидроксиды.
- •3. Амфотерные гидроксиды.
- •II. Гидроксиды неметаллов.
- •2.2.2. Получение кислот
- •2.3. Соли
- •2.3.1. Классификация солей
- •1. Средние (нормальные) соли.
- •2. Кислые соли.
- •3. Оснóвные соли.
- •4. Комплексные соли.
- •5. Двойные соли.
- •6. Смешанные соли.
- •7. Гидратные соли (кристаллогидраты).
- •2.3.2. Физические свойства солей
- •2.3.3. Химические свойства солей
- •Задание для самостоятельной работы
- •Глава 3. Основные законы химии
- •3.1. Международная система единиц (система си)
- •3.2. Атомные и молекулярные массы
- •1. Атомная (или молекулярная) масса m0.
- •2. Относительная атомная (или молекулярная) масса Ar (Mr).
- •3. Молярная масса вещества m.
- •1. Закон сохранения массы веществ.
- •2. Закон постоянства состава.
- •3. Закон стехиометрических соотношений.
- •3.4. Газовые законы
- •Решение.
- •Глава 4. Строение Атома
- •Решение.
- •4.1. Строение электронных оболочек атомов
- •4.2. Электронные конфигурации атомов
- •1. Принцип Паули.
- •2. Правило Хунда.
- •3. Принцип наименьшей энергии.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •4.3. Периодический закон д.И.Менделеева
- •Задание для самостоятельной работы
- •Глава 5. Химическая связь
- •5.1. Ковалентная связь
- •1. Обменный механизм.
- •2. Донорно-акцепторный механизм.
- •5.2. Ионная связь
- •5.3. Металлическая связь
- •5.4. Водородная связь
- •Решение.
- •Задание для самостоятельной работы
- •Глава 6. Физико-химические основы протекания химических реакций
- •6.1. Основы химической термодинамики
- •6.1.1. Термохимические уравнения и расчеты
- •I следствие:
- •Решение.
- •II следствие:
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.2. Скорость химических реакций
- •6.2.1. Основы химической кинетики
- •Решение.
- •1. Зависимость скорости реакции от концентраций реагентов.
- •Решение.
- •Решение.
- •Решение.
- •2. Зависимость скорости реакции от температуры.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.3. Химическое равновесие
- •6.3.1. Смещение химического равновесия. Принцип Ле Шателье
- •1. Влияние изменения концентрации.
- •2. Влияние температуры.
- •2. Влияние давления.
- •Решение.
- •Задача №3
- •Задача №4
- •Задание для самостоятельной работы
- •Глава 7. Растворы
- •7.1. Основные способы выражения концентрации растворов
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •7.2. Теория электролитической диссоциации
- •7.2.1. Факторы, влияющие на степень диссоциации электролитов
- •Решение.
- •7.2.2. Реакции в растворах электролитов
- •Решение.
- •7.3. Ионное произведение воды. Водородный показатель
- •Решение.
- •Решение.
- •Шкала значений pH
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •7.4.1. Усиление и подавление гидролиза
- •Решение.
- •Задание для самостоятельной работы
- •Глава 8. Окислительно-восстановительные реакции
- •8.1. Окислители и восстановители
- •8.2. Классификация окислительно-восстановительных реакций
- •8.3.2. Метод электронно-ионного баланса
- •Решение.
- •Задание для самостоятельной работы
Решение.
1) найдем массу H2SO4 в заданном растворе:
m(H2SO4) C(H2SO4)·M(H2SO4)· 0,1·98·0,25 2,45 г;
2) найдем массу 10% раствора H2SO4, который содержит 2,45 г кислоты:
![]()
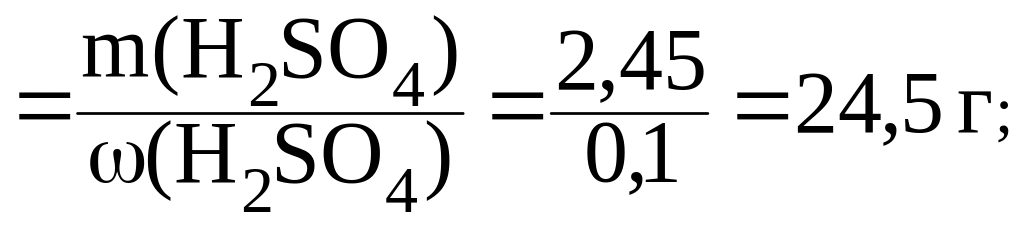
3) найдем объем 10% раствора H2SO4:
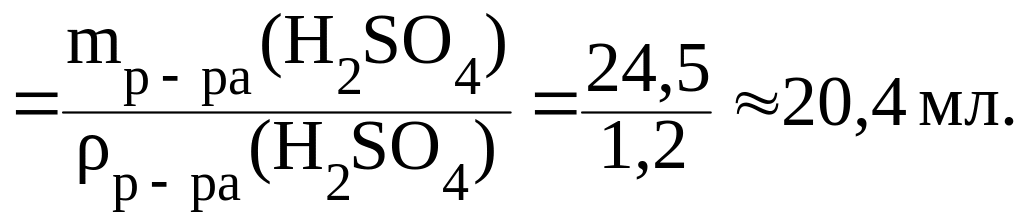
Приготовление раствора проводят следующим образом: 20,4 мл 10% р-ра H2SO4 отмеряют при помощи пипетки, переносят в мерную колбу вместимостью 250 мл и добавляют до метки дистиллиро-ванную воду.
Задание для самостоятельной работы
1. 10 г NaCl растворили в воде с использованием мерной колбы на 250 мл. Плотность раствора оказалась равна 1,05 г/мл. Для приготовленного раствора рассчитать:
а) массовую долю NaCl;
б) молярную концентрацию;
в) молярную концентрацию эквивалента;
г) титр;
д) моляльную концентрацию;
е) мольную долю NaCl.
2. Рассчитать массу стрептоцида, которая необходима для приготовления 0,5 л 1% раствора плотностью 1 г/мл.
3. Рассчитать
массу Al2(SO4)3,
которая необходима для приготовления
750 мл раствора с С(![]() Al2(SO4)3) = 0,2 моль/л.
Al2(SO4)3) = 0,2 моль/л.
4. Приготовить 400 мл раствора Na2B4O7 с (Na2B4O7) 2% плотностью 1 г/мл из кристаллогидрата Na2B4O7·10Н2О.
5. Вычислить массу воды, которую надо добавить к 300 г раствора NaCl с (NaCl) 5%, чтобы получить раствор с (NaCl) 1,5%.
6. Приготовить 100 мл раствора с С(HCl) = 0,1 моль/л из 5% раствора HCl плотностью 1,05 г/мл.
7.2. Теория электролитической диссоциации
Некоторые вещества в растворах способны распадаться на ионы. Такие вещества называют электролитами и их растворы проводят электрический ток.
Процесс распада электролита на ионы под действием молекул растворителя называется электролитической диссоциацией.
К электролитам относится кислоты, основания и соли.
Вещества, которые в растворах не распадаются на ионы, называют неэлектролитами. Растворы неэлектролитов не проводят электрический ток. К неэлектролитам относятся оксиды, газы, большинство органических соединений (углеводороды, спирты, альдегиды, кетоны и др.).
Количественной характеристикой процесса электролитической диссоциации является степень диссоциации.
Степенью диссоциации называется отношение количества электролита, распавшегося на ионы (n), к общему количеству электролита (n0):
|
(25) |
Величина выражается в долях единицы или в % и зависит от природы электролита, растворителя, температуры, концентрации и состава раствора.
По степени диссоциации электролиты условно разделяют на сильные ( > 30%), средние (3% < < 30%) и слабые ( < 3%).
К сильным электролитам относят:
1) некоторые неорганические кислоты (HCl, HBr, HI, HNO3, H2SO4, HClO4 и ряд других);
2) гидроксиды щелочных (Li, Na, K, Rb, Cs) и щелочноземельных (Ca, Sr, Ba) металлов;
3) почти все растворимые соли.
Принято считать, что эти соединения диссоциируют полностью, т.е., на 100%. Уравнения диссоциации сильных электролитов записывают следующим образом:
HCl H+ Cl;
K3PO4 3K+ PO43.
Положительно заряженный ион называется катион, отрицательно заряженный – анион.
К электролитам средней силы относят Mg(OH)2, H3PO4, HCOOH, H2SO3, HF и некоторые другие.
Слабыми электролитами считают все карбоновые кислоты (кроме HCOOH) и гидратированные формы алифатических и ароматических аминов. Слабыми электролитами являются также многие неоргани-ческие кислоты (HCN, H2S, H2CO3 и др.) и основания (NH3∙H2O).
Следует отметить, что в большинстве случаев (за исключением солей) растворимость никаким образом не связана с диссоциацией. Так, уксусная кислота и этиловый спирт неограниченно растворимы в воде, но в то же время первое вещество является слабым электро-литом, а второе неэлектролит.
Процесс диссоциации слабых и средних электролитов является обратимым:
KtnAnm ⇄ nKtm+ mAnn
и характеризуется константой равновесия, которая называется константой диссоциации:
|
(26) |
Величина
![]() зависит от природы электролита и
растворителя, а также от температуры,
но не зависит
от концентрации раствора.
зависит от природы электролита и
растворителя, а также от температуры,
но не зависит
от концентрации раствора.
Слабые одноосновные кислоты типа HA диссоциируют по общему уравнению:
HA ⇄ H+ A.
В данном случае константа диссоциации называется константой кислотности и обозначается Ka:
![]()
Константа диссоциации слабого основания называется константой основности и обозначается Kb:
NH3H2O ⇄ NH4+ OH.
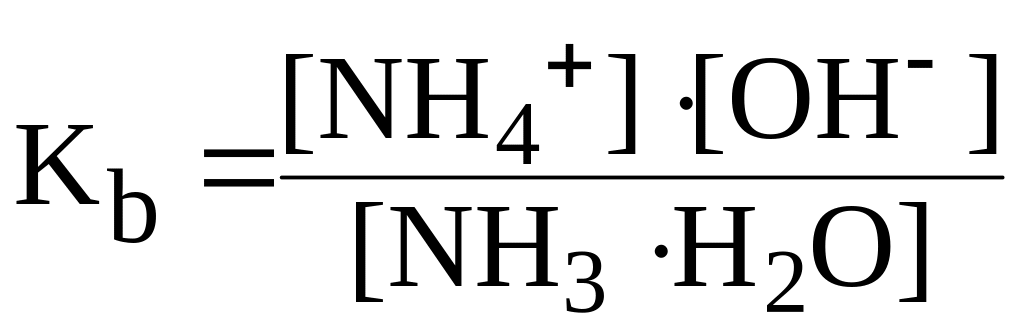
Диссоциация многоосновных кислот (многокислотных осно-ваний) происходит в несколько ступеней, каждая из которых характе-ризуется своей константой.
Например, для фосфорной кислоты имеем:
H3PO4 ⇄ H+ + H2PO4, |
|
H2PO4– ⇄ H+ + HPO42, |
|
HPO42– ⇄ H+ + PO43, |
|
Видно, что
![]() .
Данное неравенство соблюдается для
всех без исключения случаев ступенчатой
диссоциации.
.
Данное неравенство соблюдается для
всех без исключения случаев ступенчатой
диссоциации.
На основании
значений
![]() и
и
![]() можно сделать заключение о сравнительной
силе кислоты или основания:
можно сделать заключение о сравнительной
силе кислоты или основания:
Чем больше значение ( ), тем сильнее кислота (основание).
Величины констант диссоциации для слабых электролитов являются справочными данными.
Пример 1. Написать уравнения диссоциации Al2(SO4)3, H2S и NaHCO3.
Al2(SO4)3 растворимая соль, следовательно, является сильным электролитом:
Al2(SO4)3 2Al3+ 3SO42.
H2S слабая двухосновная кислота, которая диссоциирует ступенчато:
H2S ⇄ H+ + HS;
HS ⇄ H+ + S2.
NaHCO3 является растворимой солью и полностью диссоциирует на катион и анион:
NaHCO3 Na+ HCO3.
Анион HCO3 слабая кислота и диссоциирует обратимо:
HCO3 ⇄ H+ + CO32.