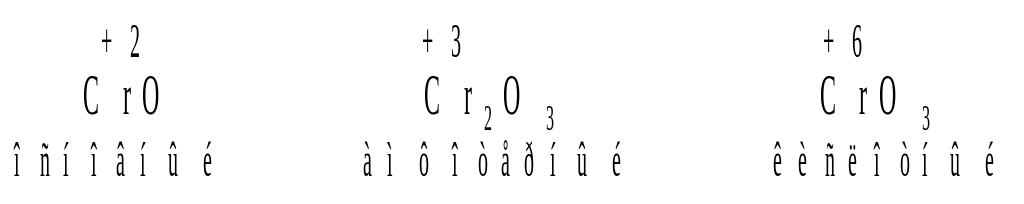- •Глава 1. Основные понятия химии
- •1.1. Составление химических формул веществ. Понятие о валентности и степени окисления
- •Задание для самостоятельной работы
- •1.2. Химические уравнения
- •1.3. Классификация химических реакций
- •Глава 2. Основные классы неорганических соединений
- •2.1. Оксиды
- •2.1.1. Получение оксидов
- •2.1.2. Классификация и свойства оксидов
- •I. Оксиды металлов.
- •1. Оснóвные оксиды.
- •2. Кислотные оксиды.
- •3. Амфотерные оксиды.
- •II. Оксиды неметаллов.
- •2.2. Гидроксиды
- •I. Гидроксиды металлов.
- •2.2.1. Получение гидроксидов металлов
- •1. Оснóвные гидроксиды.
- •2. Кислотные гидроксиды.
- •3. Амфотерные гидроксиды.
- •II. Гидроксиды неметаллов.
- •2.2.2. Получение кислот
- •2.3. Соли
- •2.3.1. Классификация солей
- •1. Средние (нормальные) соли.
- •2. Кислые соли.
- •3. Оснóвные соли.
- •4. Комплексные соли.
- •5. Двойные соли.
- •6. Смешанные соли.
- •7. Гидратные соли (кристаллогидраты).
- •2.3.2. Физические свойства солей
- •2.3.3. Химические свойства солей
- •Задание для самостоятельной работы
- •Глава 3. Основные законы химии
- •3.1. Международная система единиц (система си)
- •3.2. Атомные и молекулярные массы
- •1. Атомная (или молекулярная) масса m0.
- •2. Относительная атомная (или молекулярная) масса Ar (Mr).
- •3. Молярная масса вещества m.
- •1. Закон сохранения массы веществ.
- •2. Закон постоянства состава.
- •3. Закон стехиометрических соотношений.
- •3.4. Газовые законы
- •Решение.
- •Глава 4. Строение Атома
- •Решение.
- •4.1. Строение электронных оболочек атомов
- •4.2. Электронные конфигурации атомов
- •1. Принцип Паули.
- •2. Правило Хунда.
- •3. Принцип наименьшей энергии.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •4.3. Периодический закон д.И.Менделеева
- •Задание для самостоятельной работы
- •Глава 5. Химическая связь
- •5.1. Ковалентная связь
- •1. Обменный механизм.
- •2. Донорно-акцепторный механизм.
- •5.2. Ионная связь
- •5.3. Металлическая связь
- •5.4. Водородная связь
- •Решение.
- •Задание для самостоятельной работы
- •Глава 6. Физико-химические основы протекания химических реакций
- •6.1. Основы химической термодинамики
- •6.1.1. Термохимические уравнения и расчеты
- •I следствие:
- •Решение.
- •II следствие:
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.2. Скорость химических реакций
- •6.2.1. Основы химической кинетики
- •Решение.
- •1. Зависимость скорости реакции от концентраций реагентов.
- •Решение.
- •Решение.
- •Решение.
- •2. Зависимость скорости реакции от температуры.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.3. Химическое равновесие
- •6.3.1. Смещение химического равновесия. Принцип Ле Шателье
- •1. Влияние изменения концентрации.
- •2. Влияние температуры.
- •2. Влияние давления.
- •Решение.
- •Задача №3
- •Задача №4
- •Задание для самостоятельной работы
- •Глава 7. Растворы
- •7.1. Основные способы выражения концентрации растворов
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •7.2. Теория электролитической диссоциации
- •7.2.1. Факторы, влияющие на степень диссоциации электролитов
- •Решение.
- •7.2.2. Реакции в растворах электролитов
- •Решение.
- •7.3. Ионное произведение воды. Водородный показатель
- •Решение.
- •Решение.
- •Шкала значений pH
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •7.4.1. Усиление и подавление гидролиза
- •Решение.
- •Задание для самостоятельной работы
- •Глава 8. Окислительно-восстановительные реакции
- •8.1. Окислители и восстановители
- •8.2. Классификация окислительно-восстановительных реакций
- •8.3.2. Метод электронно-ионного баланса
- •Решение.
- •Задание для самостоятельной работы
Глава 2. Основные классы неорганических соединений
Все химические элементы делятся на металлы и неметаллы. Различие между ними по физическим свойствам очевидны: для первых характерен металлический блеск, высокая электро- и теплопроводность, пластичность, для вторых отсутствие этих характеристик. Еще более существенны различия их химических свойств.
Всего известно 22 неметалла: водород Н, гелий Не; бор В, углерод С, азот N, кислород О, фтор F, неон Ne; кремний Si, фосфор Р, сера S, хлор Сl, аргон Ar; мышьяк As, селен Se, бром Br, криптон Kr; теллур Te, иод I, ксенон Xe; астат At, радон Rn.
Остальные элементы относятся к металлам.
Ранее уже отмечалось, что все вещества делятся на простые, которые состоят из атомов одного элемента, и сложные, которые состоят из атомов разных элементов.
Важнейшими классами сложных веществ являются: оксиды, гидроксиды и соли.
2.1. Оксиды
Оксидами называют сложные вещества, состоящие из двух элементов, одним из которых является кислород.
Общая формула оксидов: ЭxOy, где Э символ элемента.
В оксидах степень окисления кислорода равна 2 (исключение: O+2F2).
Названия оксидов включают в себя название элемента с указанием его степени окисления римскими цифрами. Например: SO3 оксид серы (VI), CrO3 оксид хрома (VI) и т.д.
Физические свойства оксидов весьма разнообразны; среди них есть газообразные вещества (СО2, SO2, NO и др.), жидкости (N2O3, N2O4, Cl2O7 и др.), твердые вещества (СаО, СuO, Al2O3, SiO2 и др.).
2.1.1. Получение оксидов
Основными способами получения оксидов являются следующие:
1. Непосредственное соединение простых веществ с кислородом:
С + О2 = СО2
4Li + O2 = 2Li2O
2. Горение сложных веществ:
СН4 + 2О2 = СО2 + 2Н2О
3. Разложение кислородсодержащих соединений (гидроксидов, солей) при нагревании:
СаСО3 = СаО + СО2
2Cu(NO3)2 = 2CuO + 4NO2 + O2
2Fe(OH)3 = Fe2O3 + 3H2O
H2SiO3 = SiO2 + H2O
2.1.2. Классификация и свойства оксидов
Все оксиды делятся на солеобразующие и несолеобразующие.
I. Оксиды металлов.
Все оксиды металлов являются солеобразующими и делятся на оснóвные, амфотерные и кислотные. Кроме того, металлы образуют только твердые оксиды.
1. Оснóвные оксиды.
Основные
оксиды образуют металлы в степенях
окисления +1 и +2. Например:
![]() ,
Ca+2O,
Fe+2O
и др.
,
Ca+2O,
Fe+2O
и др.
1) Основные оксиды, образованные такими металлами как Li, Na, K, Rb, Cs, Ca, Sr и Ba, взаимодействуют с водой, образуя гидроксиды:
Na2O + H2O = 2NaOH
CaO + H2O = Ca(OH)2
Другие основные оксиды с водой не взаимодействуют:
FeO + H2O ≠
MnO + H2O ≠
2) Все основные оксиды растворяются в кислотах, образуя соль и воду:
CuO + H2SO4 = CuSO4 + H2O
FeO + 2HCl = FeCl2 + H2O
3) Основные оксиды реагируют с кислотными оксидами, образуя соли:
СаО + СО2 = СаСО3
2. Кислотные оксиды.
Кислотные
оксиды образуют металлы в высоких
степенях окисления. Например: Cr+6O3,
![]() и др.
и др.
Некоторые кислотные оксиды металлов взаимодействуют с водой с образованием кислот:
СrО3 + H2О = H2CrO4
3. Амфотерные оксиды.
Амфотерными называются оксиды, которые могут проявлять свойства основных и кислотных оксидов.
Амфотерные оксиды
образуют металлы в степенях окисления
+2, +3 и +4. Например:
Be+2O,
Zn+2O,
![]() ,
Mn+4O2
и др.
,
Mn+4O2
и др.
1) Амфотерные оксиды в воде нерастворимы и с водой непосредственно не соединяются.
2) При повышенных температурах амфотерные оксиды взаимодействуют с кислотными и основными оксидами:
Al2O3 + CaO = Ca(AlO2)2
ZnO + SO2 = ZnSO3
3) Амфотерные оксиды реагируют с кислотами, подобно основным оксидам, образуя соль и воду:
ZnO + H2SO4 = ZnSO4 + H2O
Al2O3 + 6HCl = 2AlCl3 + 3H2O
4
сплавление
Z
цинкат натрия![]() Na2ZnO2
+ H2O
Na2ZnO2
+ H2O
водный раствор
Z
тетрагидроксоцинкат натрия
Другие амфотерные оксиды ВеО, SnO и РbO образуют соединения, аналогичные по составу соединениям ZnO, а Сr2O3 соединения, подобные соединениям Al2O3.
Если металл может образовывать несколько оксидов, то по мере увеличения степени окисления металла возрастают кислотные свойства оксида: