
- •Глава 1. Основные понятия химии
- •1.1. Составление химических формул веществ. Понятие о валентности и степени окисления
- •Задание для самостоятельной работы
- •1.2. Химические уравнения
- •1.3. Классификация химических реакций
- •Глава 2. Основные классы неорганических соединений
- •2.1. Оксиды
- •2.1.1. Получение оксидов
- •2.1.2. Классификация и свойства оксидов
- •I. Оксиды металлов.
- •1. Оснóвные оксиды.
- •2. Кислотные оксиды.
- •3. Амфотерные оксиды.
- •II. Оксиды неметаллов.
- •2.2. Гидроксиды
- •I. Гидроксиды металлов.
- •2.2.1. Получение гидроксидов металлов
- •1. Оснóвные гидроксиды.
- •2. Кислотные гидроксиды.
- •3. Амфотерные гидроксиды.
- •II. Гидроксиды неметаллов.
- •2.2.2. Получение кислот
- •2.3. Соли
- •2.3.1. Классификация солей
- •1. Средние (нормальные) соли.
- •2. Кислые соли.
- •3. Оснóвные соли.
- •4. Комплексные соли.
- •5. Двойные соли.
- •6. Смешанные соли.
- •7. Гидратные соли (кристаллогидраты).
- •2.3.2. Физические свойства солей
- •2.3.3. Химические свойства солей
- •Задание для самостоятельной работы
- •Глава 3. Основные законы химии
- •3.1. Международная система единиц (система си)
- •3.2. Атомные и молекулярные массы
- •1. Атомная (или молекулярная) масса m0.
- •2. Относительная атомная (или молекулярная) масса Ar (Mr).
- •3. Молярная масса вещества m.
- •1. Закон сохранения массы веществ.
- •2. Закон постоянства состава.
- •3. Закон стехиометрических соотношений.
- •3.4. Газовые законы
- •Решение.
- •Глава 4. Строение Атома
- •Решение.
- •4.1. Строение электронных оболочек атомов
- •4.2. Электронные конфигурации атомов
- •1. Принцип Паули.
- •2. Правило Хунда.
- •3. Принцип наименьшей энергии.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •4.3. Периодический закон д.И.Менделеева
- •Задание для самостоятельной работы
- •Глава 5. Химическая связь
- •5.1. Ковалентная связь
- •1. Обменный механизм.
- •2. Донорно-акцепторный механизм.
- •5.2. Ионная связь
- •5.3. Металлическая связь
- •5.4. Водородная связь
- •Решение.
- •Задание для самостоятельной работы
- •Глава 6. Физико-химические основы протекания химических реакций
- •6.1. Основы химической термодинамики
- •6.1.1. Термохимические уравнения и расчеты
- •I следствие:
- •Решение.
- •II следствие:
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.2. Скорость химических реакций
- •6.2.1. Основы химической кинетики
- •Решение.
- •1. Зависимость скорости реакции от концентраций реагентов.
- •Решение.
- •Решение.
- •Решение.
- •2. Зависимость скорости реакции от температуры.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.3. Химическое равновесие
- •6.3.1. Смещение химического равновесия. Принцип Ле Шателье
- •1. Влияние изменения концентрации.
- •2. Влияние температуры.
- •2. Влияние давления.
- •Решение.
- •Задача №3
- •Задача №4
- •Задание для самостоятельной работы
- •Глава 7. Растворы
- •7.1. Основные способы выражения концентрации растворов
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •7.2. Теория электролитической диссоциации
- •7.2.1. Факторы, влияющие на степень диссоциации электролитов
- •Решение.
- •7.2.2. Реакции в растворах электролитов
- •Решение.
- •7.3. Ионное произведение воды. Водородный показатель
- •Решение.
- •Решение.
- •Шкала значений pH
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •7.4.1. Усиление и подавление гидролиза
- •Решение.
- •Задание для самостоятельной работы
- •Глава 8. Окислительно-восстановительные реакции
- •8.1. Окислители и восстановители
- •8.2. Классификация окислительно-восстановительных реакций
- •8.3.2. Метод электронно-ионного баланса
- •Решение.
- •Задание для самостоятельной работы
Решение.
По формуле (14):
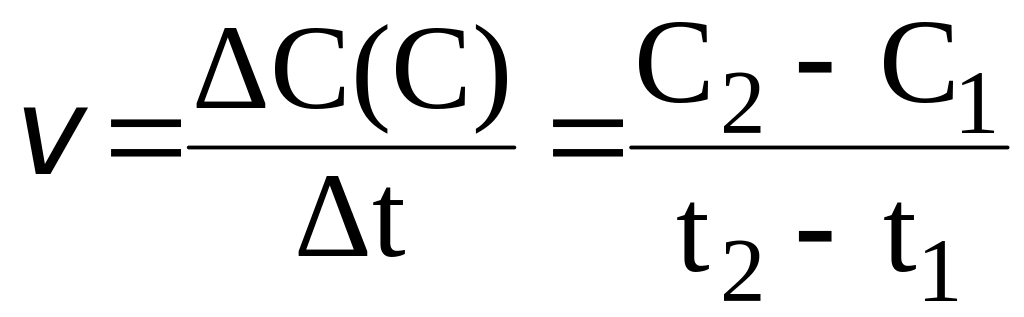 .
.
Переведем минуты в секунды и получим:
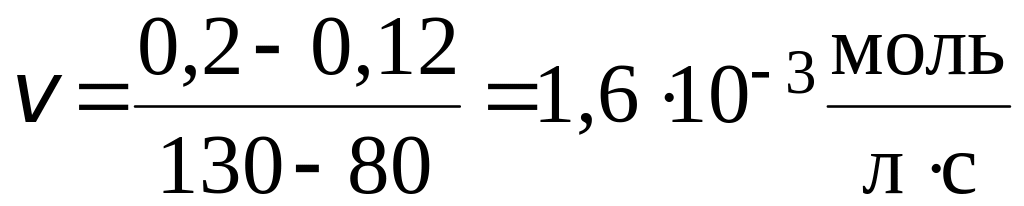 .
.
Скорость химической реакции зависит от:
1) природы реагирующих веществ;
2) концентрации реагирующих веществ;
3) температуры
4) наличия катализатора.
В некоторых случаях на скорость реакции оказывают влияние давление (если реакция протекает в газовой фазе), природа растворителя (если реакция протекает в растворе) и вид излучения (солнечная энергия, радиоактивное излучение). Скорость гетерогенных реакций зависит также от площади поверхности соприкосновения реагирующих веществ.
1. Зависимость скорости реакции от концентраций реагентов.
Влияние концентраций реагирующих веществ на скорость реакции выражается законом действующих масс:
Скорость химической реакции, протекающей при постоянной температуре в гомогенной среде, пропорциональна произведению концентраций реагирующих веществ в степенях, равных коэффи-циентам, стоящим перед формулами этих веществ в уравнении реакции.
Так, для реакции, протекающей по уравнению:
aA bB cC dD,
скорости прямой и обратной реакций определяются выражениями:
![]()
![]()
где k1 и k2 – константы скоростей прямой и обратной реакций.
Уравнения, выражающие зависимость скорости химических реакций от концентраций реагентов, называют кинетическими.
Коэффициент пропорциональности k называют константой скорости химической реакции.
Величина k зависит от природы реагирующих веществ, температуры и наличия катализатора, но не зависит от концентрации реагирующих веществ. Физический смысл константы скорости реакции заключается в следующем: она равна скорости реакции в случае, если концентрации всех реагирующих веществ равны и составляют 1 моль/л (или произведение концентраций реагентов равно 1).
Например:
H2(газ) I2(газ) ⇄ 2HI(газ)
![]() ;
;
![]() .
.
Если система гетерогенна, то концентрация твердой фазы в кинетическом уравнении учитывается в значении константы скорости (т.е., в явном виде в уравнении не присутствует):
S(тв) + O2(газ) ⇄ SO2(газ)
![]() ;
;
![]() .
.
Пример 2. В сосуде смешали газ А количеством вещества 4,5 моль и газ В количеством вещества 3 моль. Газы А и В реагируют в соответствии с уравнением А В С. Через некоторое время в системе образовался газ С количеством вещества 2 моль. Определить количества газов А и В, не вступивших в реакцию.
Решение.
Из уравнения реакции следует, что:
n(A) n(B) n(C) 2 моль,
где n ‑ изменение количества вещества в ходе реакции.
Следовательно, в сосуде осталось:
n2(A) n1(А) n(A); n2(A) (4,5 2) моль 2,5 моль;
n2(B) n1(B) n(B); n2(B) (3 2) моль 1 моль.
Пример 3. Реакция протекает по уравнению: 2A B = C. При начальных концентрациях веществ С(A) 10 моль/л; С(B) 5 моль/л скорость реакции равна 15 моль/лс. Рассчитать константу скорости и скорость прямой реакции в момент времени, когда прореагирует 50% вещества B. Определить, как и во сколько раз изменится скорость химической реакции.
Решение.
Согласно закону действующих масс:
![]() ;
;
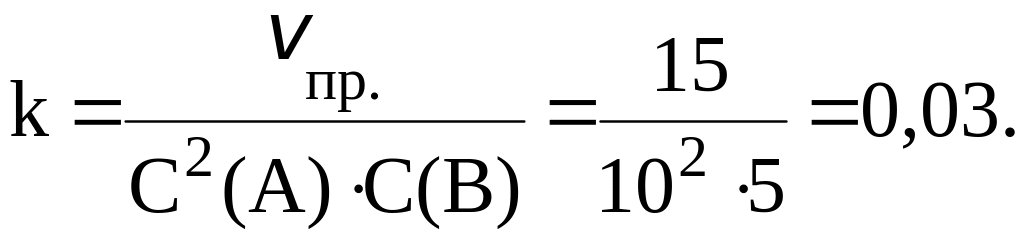
Концентрация вещества B, вступившего в реакцию, равна:
С(B) 0,5·5 2,5 моль/л.
Согласно закону стехиометрических соотношений количество прореагировавшего вещества A в 2 раза больше количества вещества B, вступившего в реакцию:
Спр.(A) = 2C пр.(B) = 22,5 = 5 моль/л.
После протекания реакции С(A) и С(B) равны:
С(A) 10 5 5 моль/л;
С(B) = 5 2,5 = 2,5 моль/л.
В данный момент скорость прямой реакции будет равна:
![]()
Таким образом, скорость химической реакции изменится:
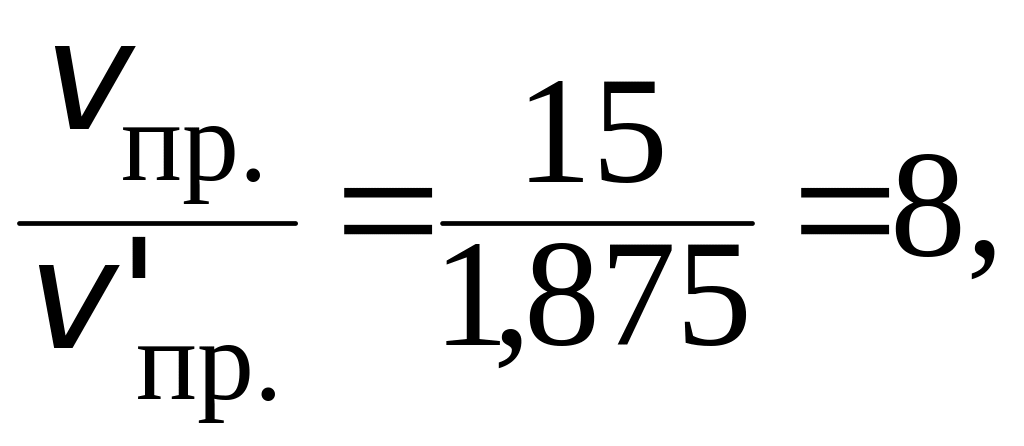
т. е. уменьшится в 8 раз.
На скорость протекания газофазных реакций оказывает влияние давление. В таких случаях вместо концентраций часто используют парциальные давления газов p. Изменение общего давления в системе приводит к симбатному (в такое же число раз) изменению парциальных давлений газов и, следовательно, и их концентраций.
Пример 4. Газофазная реакция протекает в замкнутом сосуде по уравнению: А 2В 2С. Начальные концентрации веществ равны: С0(A) 1 моль/л; С0(B) 3 моль/л; С0(C) 2 моль/л. Рассчитать, как и во сколько раз изменятся скорости прямой и обратной реакций, если давление в системе увеличить в 3 раза.
