
- •Глава 1. Основные понятия химии
- •1.1. Составление химических формул веществ. Понятие о валентности и степени окисления
- •Задание для самостоятельной работы
- •1.2. Химические уравнения
- •1.3. Классификация химических реакций
- •Глава 2. Основные классы неорганических соединений
- •2.1. Оксиды
- •2.1.1. Получение оксидов
- •2.1.2. Классификация и свойства оксидов
- •I. Оксиды металлов.
- •1. Оснóвные оксиды.
- •2. Кислотные оксиды.
- •3. Амфотерные оксиды.
- •II. Оксиды неметаллов.
- •2.2. Гидроксиды
- •I. Гидроксиды металлов.
- •2.2.1. Получение гидроксидов металлов
- •1. Оснóвные гидроксиды.
- •2. Кислотные гидроксиды.
- •3. Амфотерные гидроксиды.
- •II. Гидроксиды неметаллов.
- •2.2.2. Получение кислот
- •2.3. Соли
- •2.3.1. Классификация солей
- •1. Средние (нормальные) соли.
- •2. Кислые соли.
- •3. Оснóвные соли.
- •4. Комплексные соли.
- •5. Двойные соли.
- •6. Смешанные соли.
- •7. Гидратные соли (кристаллогидраты).
- •2.3.2. Физические свойства солей
- •2.3.3. Химические свойства солей
- •Задание для самостоятельной работы
- •Глава 3. Основные законы химии
- •3.1. Международная система единиц (система си)
- •3.2. Атомные и молекулярные массы
- •1. Атомная (или молекулярная) масса m0.
- •2. Относительная атомная (или молекулярная) масса Ar (Mr).
- •3. Молярная масса вещества m.
- •1. Закон сохранения массы веществ.
- •2. Закон постоянства состава.
- •3. Закон стехиометрических соотношений.
- •3.4. Газовые законы
- •Решение.
- •Глава 4. Строение Атома
- •Решение.
- •4.1. Строение электронных оболочек атомов
- •4.2. Электронные конфигурации атомов
- •1. Принцип Паули.
- •2. Правило Хунда.
- •3. Принцип наименьшей энергии.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •4.3. Периодический закон д.И.Менделеева
- •Задание для самостоятельной работы
- •Глава 5. Химическая связь
- •5.1. Ковалентная связь
- •1. Обменный механизм.
- •2. Донорно-акцепторный механизм.
- •5.2. Ионная связь
- •5.3. Металлическая связь
- •5.4. Водородная связь
- •Решение.
- •Задание для самостоятельной работы
- •Глава 6. Физико-химические основы протекания химических реакций
- •6.1. Основы химической термодинамики
- •6.1.1. Термохимические уравнения и расчеты
- •I следствие:
- •Решение.
- •II следствие:
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.2. Скорость химических реакций
- •6.2.1. Основы химической кинетики
- •Решение.
- •1. Зависимость скорости реакции от концентраций реагентов.
- •Решение.
- •Решение.
- •Решение.
- •2. Зависимость скорости реакции от температуры.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.3. Химическое равновесие
- •6.3.1. Смещение химического равновесия. Принцип Ле Шателье
- •1. Влияние изменения концентрации.
- •2. Влияние температуры.
- •2. Влияние давления.
- •Решение.
- •Задача №3
- •Задача №4
- •Задание для самостоятельной работы
- •Глава 7. Растворы
- •7.1. Основные способы выражения концентрации растворов
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •7.2. Теория электролитической диссоциации
- •7.2.1. Факторы, влияющие на степень диссоциации электролитов
- •Решение.
- •7.2.2. Реакции в растворах электролитов
- •Решение.
- •7.3. Ионное произведение воды. Водородный показатель
- •Решение.
- •Решение.
- •Шкала значений pH
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •7.4.1. Усиление и подавление гидролиза
- •Решение.
- •Задание для самостоятельной работы
- •Глава 8. Окислительно-восстановительные реакции
- •8.1. Окислители и восстановители
- •8.2. Классификация окислительно-восстановительных реакций
- •8.3.2. Метод электронно-ионного баланса
- •Решение.
- •Задание для самостоятельной работы
8.3.2. Метод электронно-ионного баланса
Сведение реакций окисления-восстановления к изменению степеней окисления отдельных атомов сильно упрощает понимание и искажает суть протекающих при этом процессов. Особенно важно учитывать это обстоятельство при рассмотрении реакций, протекающих в растворах. Дело в том, что атомы, меняющие свою степень окисления, входят в состав молекул или ионов, образующихся в результате диссоциации. Именно эти частицы, а не атомы, участвуют в полуреакциях. Поэтому при описании реакций окисления-восстановления, происходящих в растворах, связывать результат реакции следует не с изменением степеней окисления атомов, а с протеканием двух ионно-молекулярных полуреакций окисления и восстановления с участием реальных молекул и ионов, которые существуют в растворе.
Наряду с восстановителем и окислителем в реакциях часто принимают участие молекулы воды или ионы Н+ и ОН, определяющие характер среды. При написании полуреакций, протекающих в кислой среде, используют только катионы Н+ или молекулы Н2О; при написании полуреакций, протекающих в щелочной среде только анионы ОН или молекулы Н2О. Если же реакция протекает в нейтральной среде, то в левой части уравнения обычно записывают воду, а в правой ионы Н+ и ОН в зависимости от продуктов реакции.
В некоторых случаях характер оказывает определяющее влияние на природу продуктов реакции. Так перманганат-ион MnO4, проявляющий свойства окислителя, в кислой среде восстанавливается до ионов Mn2+:
MnO4 + 8H+ + 5ē = Mn2+ + 4H2O;
в нейтральной до осадка MnO2:
MnO4 + 2H2O + 3ē = MnO2 + 4OH
в щелочной до манганат-иона MnO42:
MnO4 + 1ē = MnO42
Характер восстановления другого сильного окислителя дихромат-иона Cr2O72 также сильно зависит от реакции среды раствора:
среда |
полуреакция |
кислая |
Cr2O72 + 14H+ + 6ē = 2Cr3+ + 7H2O |
нейтральная |
Cr2O72 + 7H2O + 6ē = 2Cr(OH)3 + 8OH |
Уравнивание кислорода в кислой, нейтральной и щелочной средах происходит по-разному.
В кислой и нейтральной среде в ту часть уравнения, где недостаток кислорода, записывают столько молекул H2O, каков недостаток кислорода, а в противоположную часть полуреакции – соответствующее число ионов H+:
AsO3 + H2O AsO4 + 2H+
В щелочной среде в ту часть уравнения, где кислород в недостатке, записывают вдвое больше ионов гидроксида, чем не хватает кислорода, а в противоположную часть полуреакции – соответствующее число молекул Н2О:
Cl2 + 12OH 2ClO3 + 6H2O
В нейтральной среде прием уравнивания зависит от продуктов реакции.
Отметим, что если реакция протекает в кислой среде, то недопустимо использование ионов OH ни в одной из частей уравнения полуреакции. И наоборот, если реакция протекает в щелочной среде, то нельзя использовать ионы H+.
Некоторые наиболее распространенные полуреакции:
1) Окисление:
Fe2+ 1ē = Fe3+
NO2 + H2O 2ē = NO3 + 2H+
SO32 + H2O 2ē = SO42 + 2H+
H2S 2ē = S + 2H+
S2 + 4H2O 8ē = SO42 + 8H+
Атомы неметаллов могут быть окислены до оксидов или анионов соответствующих кислот:
С + 2H2O 4ē = CO2 + 4H+
S + 4H2O 6ē = SO42 + 8H+
P + 4H2O 5ē = PO43 + 8H+
2) Восстановление:
Hal2 + 2ē = 2Hal (Hal F, Cl, Br, I)
MnO2 + 4H+ + 2ē = Mn2+ + 2H2O
PbO2 + 4H+ + 2ē = Pb2+ + 2H2O
ClO + 2H+ + 2ē = Cl + H2O
Окислительные свойства проявляют азотная и серная кислоты. В разбавленной серной кислоте окислителем является протон H+:
2H+ + 2ē = H2
Это слабый окислитель, способный окислять только металлы, стоящие в ряду напряжений до водорода:
0 +1 +2 0
Zn + H2SO4 = ZnSO4 + H2
В концентрированной серной кислоте окислителем является сульфат-анион SO42. Это более сильный окислитель по сравнению с протоном H+, поэтому концентрированная серная кислота окисляет некоторые металлы, стоящие в ряду напряжений после водорода (Cu, Ag). Продукты восстановления сульфат-аниона во многом опреде-ляются природой восстановителя:
восстановитель |
полуреакция |
щелочные металлы (K, Na) |
SO42 + 10H+ + 8ē = H2S + 4H2O |
активные металлы (Zn, Cd) |
SO42 + 8H+ + 6ē = S + 4H2O |
малоактивные металлы (Cu) или неметаллы (C, S, P) |
SO42 + 4H+ + 2ē = SO2 + 2H2O |
В азотной кислоте окислителем всегда является анион NO3, поэтому при взаимодействии с металлами и неметаллами азотная кислота, восстанавливаясь, никогда не выделяет водород. Состав продуктов восстановления HNO3 зависит от концентрации кислоты и природы восстановителя. Чем активнее восстановитель и более разбавлена кислота, тем глубже протекает восстановление азота:
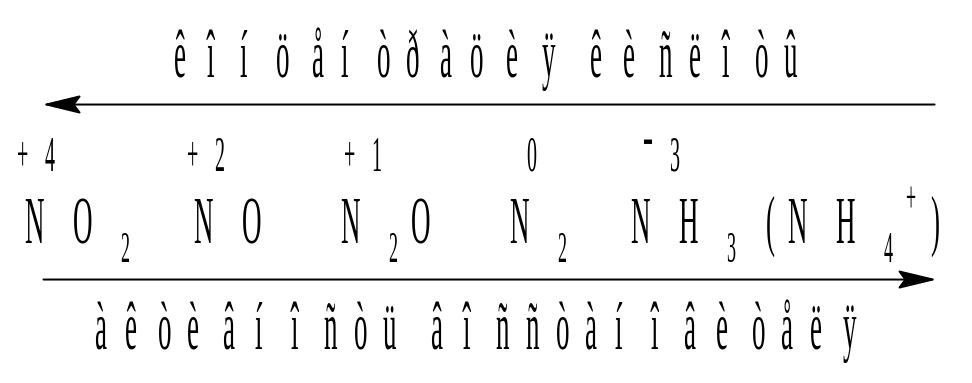
Некоторые полуреакции восстановления нитрат-иона:
2NO3 + 10H+ + 8ē = NH4NO3 + 3H2O
2NO3 + 10H+ + 8ē = N2O + 5H2O
2NO3 + 12H+ + 10ē = N2 + 6H2O
NO3 + 4H+ + 3ē = NO + 2H2O
NO3 + 2H+ + ē = NO2 + H2O
В пероксиде водорода атом кислорода находится в степени окисления 1 и может как окисляться, так и восстанавливаться:
Окисление:
в нейтральной и кислой среде: |
H2O2 2ē = O2 + 2H+ |
в щелочной среде |
H2O2 + 2OH 2ē = O2 + 2H2O |
Восстановление:
в кислой среде: |
H2O2 + 2H+ + 2ē = 2H2O |
в нейтральной и щелочной среде |
H2O2 + 2ē = 2OH |
Пример 1. Методом электронно-ионного баланса уравнять окислительно-восстановительную реакцию, протекающую по схеме:
FeSO4 + KMnO4 + H2SO4 Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
