
- •Глава 1. Основные понятия химии
- •1.1. Составление химических формул веществ. Понятие о валентности и степени окисления
- •Задание для самостоятельной работы
- •1.2. Химические уравнения
- •1.3. Классификация химических реакций
- •Глава 2. Основные классы неорганических соединений
- •2.1. Оксиды
- •2.1.1. Получение оксидов
- •2.1.2. Классификация и свойства оксидов
- •I. Оксиды металлов.
- •1. Оснóвные оксиды.
- •2. Кислотные оксиды.
- •3. Амфотерные оксиды.
- •II. Оксиды неметаллов.
- •2.2. Гидроксиды
- •I. Гидроксиды металлов.
- •2.2.1. Получение гидроксидов металлов
- •1. Оснóвные гидроксиды.
- •2. Кислотные гидроксиды.
- •3. Амфотерные гидроксиды.
- •II. Гидроксиды неметаллов.
- •2.2.2. Получение кислот
- •2.3. Соли
- •2.3.1. Классификация солей
- •1. Средние (нормальные) соли.
- •2. Кислые соли.
- •3. Оснóвные соли.
- •4. Комплексные соли.
- •5. Двойные соли.
- •6. Смешанные соли.
- •7. Гидратные соли (кристаллогидраты).
- •2.3.2. Физические свойства солей
- •2.3.3. Химические свойства солей
- •Задание для самостоятельной работы
- •Глава 3. Основные законы химии
- •3.1. Международная система единиц (система си)
- •3.2. Атомные и молекулярные массы
- •1. Атомная (или молекулярная) масса m0.
- •2. Относительная атомная (или молекулярная) масса Ar (Mr).
- •3. Молярная масса вещества m.
- •1. Закон сохранения массы веществ.
- •2. Закон постоянства состава.
- •3. Закон стехиометрических соотношений.
- •3.4. Газовые законы
- •Решение.
- •Глава 4. Строение Атома
- •Решение.
- •4.1. Строение электронных оболочек атомов
- •4.2. Электронные конфигурации атомов
- •1. Принцип Паули.
- •2. Правило Хунда.
- •3. Принцип наименьшей энергии.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •4.3. Периодический закон д.И.Менделеева
- •Задание для самостоятельной работы
- •Глава 5. Химическая связь
- •5.1. Ковалентная связь
- •1. Обменный механизм.
- •2. Донорно-акцепторный механизм.
- •5.2. Ионная связь
- •5.3. Металлическая связь
- •5.4. Водородная связь
- •Решение.
- •Задание для самостоятельной работы
- •Глава 6. Физико-химические основы протекания химических реакций
- •6.1. Основы химической термодинамики
- •6.1.1. Термохимические уравнения и расчеты
- •I следствие:
- •Решение.
- •II следствие:
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.2. Скорость химических реакций
- •6.2.1. Основы химической кинетики
- •Решение.
- •1. Зависимость скорости реакции от концентраций реагентов.
- •Решение.
- •Решение.
- •Решение.
- •2. Зависимость скорости реакции от температуры.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.3. Химическое равновесие
- •6.3.1. Смещение химического равновесия. Принцип Ле Шателье
- •1. Влияние изменения концентрации.
- •2. Влияние температуры.
- •2. Влияние давления.
- •Решение.
- •Задача №3
- •Задача №4
- •Задание для самостоятельной работы
- •Глава 7. Растворы
- •7.1. Основные способы выражения концентрации растворов
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •7.2. Теория электролитической диссоциации
- •7.2.1. Факторы, влияющие на степень диссоциации электролитов
- •Решение.
- •7.2.2. Реакции в растворах электролитов
- •Решение.
- •7.3. Ионное произведение воды. Водородный показатель
- •Решение.
- •Решение.
- •Шкала значений pH
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •7.4.1. Усиление и подавление гидролиза
- •Решение.
- •Задание для самостоятельной работы
- •Глава 8. Окислительно-восстановительные реакции
- •8.1. Окислители и восстановители
- •8.2. Классификация окислительно-восстановительных реакций
- •8.3.2. Метод электронно-ионного баланса
- •Решение.
- •Задание для самостоятельной работы
Задание для самостоятельной работы
1. Дайте характеристику элементов №13, 16, 30, 34, 50, 53, по следующему плану:
1) напишите электронную форму элемента;
2) изобразите электронно-структурную формулу его валентных уровней;
3) определите, относится элемент к металлам или неметаллам;
4) сравните его свойства со свойствами соседей по периоду и по группе;
5) определите характерные степени окисления этого элемента в соединениях;
6) определите формулу высшего оксида и соответствующего ему гидроксида, а также характер этих соединений.
Глава 5. Химическая связь
Наибольшей устойчивостью обладают электронные оболочки атомов, состоящих из двух или восьми электронов. Этим объясняется факт, что благородные газы (He, Ar и др.) при обычных условиях не вступают в химические реакции с другими элементами. Это позволило сформулировать следующее положение:
При образовании молекулы атомы стремятся приобрести устойчивую двухэлектронную (дублет) или восьмиэлектронную (октет) электронные оболочки.
Таким образом, молекула представляет собой электро-нейтральную систему, состоящую из взаимодействующих электронов и нескольких ядер. Взаимодействие валентных электронов образует химическую связь. Это взаимодействие может осуществляться по-разному. Различают три основных вида химических связей: ковалентную, ионную и металлическую.
5.1. Ковалентная связь
Связь, образованная за счет образования электронных пар, в одинаковой мере принадлежащим обоим атомам, называется ковалентной.
Ковалентная связь может образовываться по двум механизмам: обменному и донорно-акцепторному.
1. Обменный механизм.
Обменный механизм образования ковалентной связи заключается в перекрывании электронных оболочек атомов. При этом образуется общая пара электронов, принадлежащая обоим атомам. Так, атом водорода имеет электронное строение 1s1 и для завершения внешней электронной оболочки ему не хватает одного электрона. При сближении двух атомов водорода происходит перекрывание 1s-орбиталей и образование общей электронной пары:
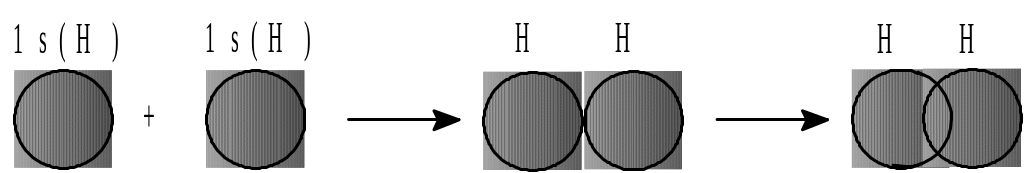
Рис. 3. Образование молекулы водорода.
Теперь каждый атом водорода теперь имеет завершенный внешний электронный уровень. Этим объясняется факт, что молекула водорода состоит из двух атомов.
Обычно наибольшее перекрывание электронных облаков осуществляется вдоль линии, соединяющей ядра двух атомов.
Ковалентная связь, которая образуется при перекрывании орбиталей вдоль линии, связывающей центры соединяющихся атомов, называется -связью.
Химическую связь можно изобразить:
1) в виде точек, обозначающих электроны и поставленных у химического знака элемента:
![]()
2) с помощью квантовых ячеек (орбиталей), в которых размещены электроны с противоположными спинами:
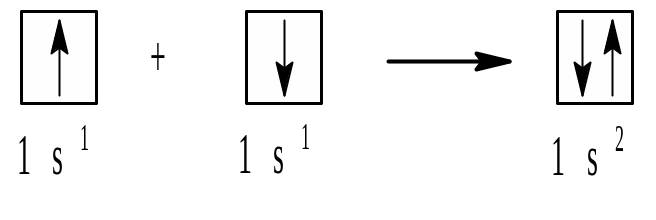
3) черточкой, которая символизирует пару электронов: Н Н.
В молекуле хлора Cl2 ковалентная связь также возникает путем образования общей электронной пары. Внешняя электронная оболочка атома оболочка состоит из 7 валентных электронов: 2s22p5:
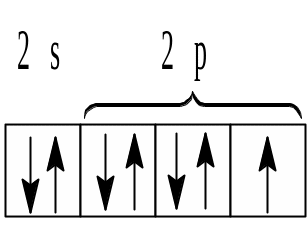
Шесть электронов образуют неподеленные пары, а один электрон остается неспаренным. Таким образом, для завершения внешней электронной оболочки атому хлора также недостает одного электрона и образование химической связи происходит именно за счет неспаренных электронов каждого атома хлора. Они и образуют общую пару электронов. Каждый атом хлора становится обладателем 8 электронов, т.е. приобретает устойчивую конфигурацию благородного газа.
Это также s-связь, но она образована перекрыванием р-орбиталей по одной из осей:

Рис. 4. Образование молекулы хлора.
Если в реагирующих атомах имеется 2 или 3 неспаренных электрона, то могут образоваться не 1, а 2 или 3 связи, т.е. 2 или 3 общие электронные пары. Если между атомами возникла одна ковалентная связь, то она называется одинарной, если две двойной, если три тройной. Они обозначаются соответственно или . Двойная связь образуется, например, в молекуле кислорода O2 (O O), тройная в молекуле азота N2 (N N).
Орбитали 2р-электронов расположены взаимно перпендикулярно, т.е. по осям х, у и z. В молекуле азота перекрывание орбиталей по оси х приводит к образованию s-связи (так как происходит вдоль линии, связывающей центры атомов), а перекрывание по осям у и z происходит по обе стороны линии, связывающей центры соединяющихся атомов.
Ковалентная связь, возникающая при перекрывании орбиталей по обе стороны линии, связывающей центры соединяющихся атомов, называется p-связью.
Взаимное перекрывание орбиталей в случае p-связи меньше, чем в случае -связи, поэтому -связь всегда менее прочная, чем -связь. Но в сумме три связи (sх + pу + pz) придают молекуле N2 большую прочность, поэтому молекула азота при обычных условиях отличается низкой реакционной способностью.
Рассмотренные нами случаи относятся к разновидности связи, называемой ковалентной неполярной. Такая связь возникает между одинаковыми атомами.
Ковалентная связь может возникать не только между одинаковыми, но и между различными атомами. Так, взаимодействие между атомами водорода и хлора:
![]()
приводит к перекрыванию s-орбитали атома водорода и p-орбитали атома хлора:
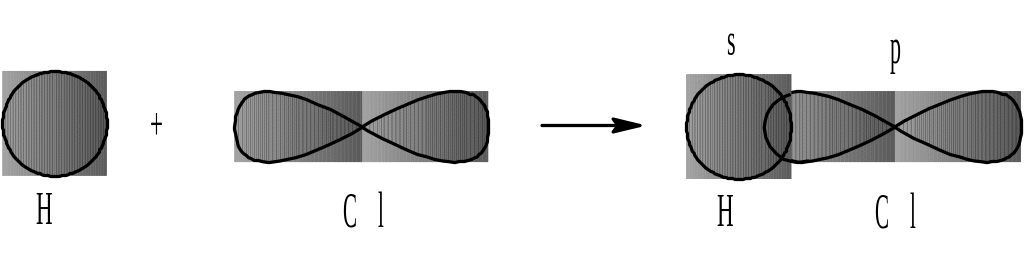
Рис. 5. Образование молекулы HCl.
В этом случае электронное облако связи смещено к атому с большей относительной электроотрицательностью. Такой вид связи называется ковалентной полярной.
Электроотрицательностью называют способность атома притягивать к себе электроны.
В периодической системе Д.И.Менделеева электроотрицатель-ность (ЭО) элементов увеличивается слева направо и снизу вверх. Таким образом, самым электроотрицательным элементом является фтор. ЭО не может быть выражена в каких-либо единицах, поэтому для ее количественного определения предложено несколько шкал относительных ЭО, из которых наиболее распространенной является шкала Полинга.
Таблица 5. Значения ЭО некоторых элементов по Полингу.
Элемент |
ЭО |
Элемент |
ЭО |
Элемент |
ЭО |
Rb |
0,8 |
Al |
1,6 |
C |
2,5 |
K |
0,8 |
Fe |
1,8 |
S |
2,6 |
Na |
0,9 |
Si |
1,9 |
I |
2,7 |
Li |
1,0 |
Ge |
2,0 |
N |
3,0 |
Sr |
1,0 |
As |
2,0 |
Br |
3,0 |
Ca |
1,0 |
B |
2,0 |
Cl |
3,2 |
Mg |
1,3 |
H |
2,1 |
O |
3,5 |
Be |
1,6 |
P |
2,2 |
F |
4,0 |
Чем больше разность ЭО элементов (x), тем более полярной является связь между ними. У атома с большей электроотрицательностью возникает избыток электронной плотности, который обозначают . У другого атома возникает дефицит электронной плотности, который обозначают +. Электрические центры положительных и отрицательных зарядов в таких молекулах не совпадают в одной точке, а находятся на некотором расстоянии l. Таким образом, при общей электронейтральности молекула HCl представляет собой электрический диполь с зарядом у атома хлора и с зарядом d+ у атома водорода.
