
- •Глава 1. Основные понятия химии
- •1.1. Составление химических формул веществ. Понятие о валентности и степени окисления
- •Задание для самостоятельной работы
- •1.2. Химические уравнения
- •1.3. Классификация химических реакций
- •Глава 2. Основные классы неорганических соединений
- •2.1. Оксиды
- •2.1.1. Получение оксидов
- •2.1.2. Классификация и свойства оксидов
- •I. Оксиды металлов.
- •1. Оснóвные оксиды.
- •2. Кислотные оксиды.
- •3. Амфотерные оксиды.
- •II. Оксиды неметаллов.
- •2.2. Гидроксиды
- •I. Гидроксиды металлов.
- •2.2.1. Получение гидроксидов металлов
- •1. Оснóвные гидроксиды.
- •2. Кислотные гидроксиды.
- •3. Амфотерные гидроксиды.
- •II. Гидроксиды неметаллов.
- •2.2.2. Получение кислот
- •2.3. Соли
- •2.3.1. Классификация солей
- •1. Средние (нормальные) соли.
- •2. Кислые соли.
- •3. Оснóвные соли.
- •4. Комплексные соли.
- •5. Двойные соли.
- •6. Смешанные соли.
- •7. Гидратные соли (кристаллогидраты).
- •2.3.2. Физические свойства солей
- •2.3.3. Химические свойства солей
- •Задание для самостоятельной работы
- •Глава 3. Основные законы химии
- •3.1. Международная система единиц (система си)
- •3.2. Атомные и молекулярные массы
- •1. Атомная (или молекулярная) масса m0.
- •2. Относительная атомная (или молекулярная) масса Ar (Mr).
- •3. Молярная масса вещества m.
- •1. Закон сохранения массы веществ.
- •2. Закон постоянства состава.
- •3. Закон стехиометрических соотношений.
- •3.4. Газовые законы
- •Решение.
- •Глава 4. Строение Атома
- •Решение.
- •4.1. Строение электронных оболочек атомов
- •4.2. Электронные конфигурации атомов
- •1. Принцип Паули.
- •2. Правило Хунда.
- •3. Принцип наименьшей энергии.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •4.3. Периодический закон д.И.Менделеева
- •Задание для самостоятельной работы
- •Глава 5. Химическая связь
- •5.1. Ковалентная связь
- •1. Обменный механизм.
- •2. Донорно-акцепторный механизм.
- •5.2. Ионная связь
- •5.3. Металлическая связь
- •5.4. Водородная связь
- •Решение.
- •Задание для самостоятельной работы
- •Глава 6. Физико-химические основы протекания химических реакций
- •6.1. Основы химической термодинамики
- •6.1.1. Термохимические уравнения и расчеты
- •I следствие:
- •Решение.
- •II следствие:
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.2. Скорость химических реакций
- •6.2.1. Основы химической кинетики
- •Решение.
- •1. Зависимость скорости реакции от концентраций реагентов.
- •Решение.
- •Решение.
- •Решение.
- •2. Зависимость скорости реакции от температуры.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •6.3. Химическое равновесие
- •6.3.1. Смещение химического равновесия. Принцип Ле Шателье
- •1. Влияние изменения концентрации.
- •2. Влияние температуры.
- •2. Влияние давления.
- •Решение.
- •Задача №3
- •Задача №4
- •Задание для самостоятельной работы
- •Глава 7. Растворы
- •7.1. Основные способы выражения концентрации растворов
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Задание для самостоятельной работы
- •7.2. Теория электролитической диссоциации
- •7.2.1. Факторы, влияющие на степень диссоциации электролитов
- •Решение.
- •7.2.2. Реакции в растворах электролитов
- •Решение.
- •7.3. Ионное произведение воды. Водородный показатель
- •Решение.
- •Решение.
- •Шкала значений pH
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •Решение.
- •7.4.1. Усиление и подавление гидролиза
- •Решение.
- •Задание для самостоятельной работы
- •Глава 8. Окислительно-восстановительные реакции
- •8.1. Окислители и восстановители
- •8.2. Классификация окислительно-восстановительных реакций
- •8.3.2. Метод электронно-ионного баланса
- •Решение.
- •Задание для самостоятельной работы
Решение.
Желудочный сок имеет кислую реакцию среды (pH < 7), плазма крови слабощелочную (pH в интервале от 7 до 9), а слюна слабокислую (pH в интервале от 5 до 7).
Пример
2.
Концентрация ионов [H![]() ]
в растворе составляет 10−5 моль/л.
Определить значения pH,
pOH
и концентрацию ионов [OH
]
в растворе составляет 10−5 моль/л.
Определить значения pH,
pOH
и концентрацию ионов [OH![]() ]
в растворе. Оценить характер среды.
]
в растворе. Оценить характер среды.
Решение.
1) ![]() ;
;
2) по формуле (35) находим: pOH = 14 pH = 14 5 = 9;
3) используя
основное логарифмическое тождество,
получим:
![]()
4) Среда слабокислая, так как pH = 5.
Шкала значений pH
 Таблица
6. Взаимосвязь концентраций ионов H+
и OH.
Таблица
6. Взаимосвязь концентраций ионов H+
и OH.
рН |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
[H ], моль/л |
100 |
10−1 |
10−2 |
10−3 |
10−4 |
10−5 |
10−6 |
10−7 |
10−8 |
10−9 |
10−10 |
10−11 |
10−12 |
10−13 |
10−14 |
[OH ], моль/л |
10−14 |
10−13 |
10−12 |
10−11 |
10−10 |
10−9 |
10−8 |
10−7 |
10−6 |
10−5 |
10−4 |
10−3 |
10−2 |
10−1 |
100 |
рОН |
14 |
13 |
12 |
11 |
10 |
9 |
8 |
7 |
6 |
5 |
4 |
3 |
2 |
1 |
0 |
Пример 3. Вычислить рН раствора соляной кислоты с молярной концентрацией 0,01 моль/л.
Решение.
Так как HCl сильный электролит:
HCl H+ + Cl
то из уравнения диссоциации видно, что C(H+) = C(HCl) = 10−2 моль/л.
Отсюда:
![]()
Пример 4. Рассчитать рН раствора NaOH, если известно, что в 100 мл этого раствора содержится 0,004 г NaOH.
Решение.
Так как NaOH сильный электролит:
NaOH Na+ + OH
то C(OH) = C(NaOH).
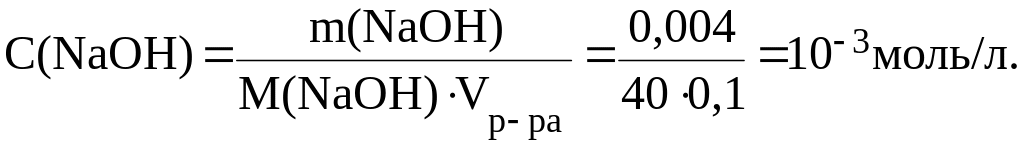
Отсюда:
![]()
pH = 14 pOH = 14 3 = 11.
Задание для самостоятельной работы
1. Определить, как изменится значение ионного произведения воды, если к раствору добавить:
а) HCl;
б) KOH.
2. Определить значения pH, [Н+] и [ОН], если рOН раствора равен 4. Оценить характер среды.
3. Вычислить рН раствора серной кислоты с молярной концентрацией 0,005 моль/л.
4. Рассчитать рН раствора KOH, если известно, что в 200 мл этого раствора содержится 0,112 г щелочи.
7.4. Гидролиз солей
Теория электролитической диссоциации объясняет еще одно явление, связанное с растворами гидролиз солей. Растворы многих средних солей имеют щелочную или кислую реакцию, хотя молекулы этих солей не содержат в своем составе ни катионов водорода, ни гидроксид-ионов. Причина этого явления взаимодействие солей с водой, которое называют гидролизом солей.
Гидролизом солей называется обменное взаимодействие ионов соли с водой, приводящее к образованию малодиссоциированных соединений или ионов, что вызывает изменение рН раствора.
Соли, образованные катионами сильных оснований и анионами сильных кислот (Na2SO4, CaCl2, KI, Sr(NO3)2 и др.), не гидролизуются, так как катионы и анионы этих солей не образуют с водой малодиссоциированных электролитов. Водные растворы таких солей имеют нейтральную реакцию среды (рН = 7).
Гидролизу подвергаются три типа солей.
1. Соли, образованные катионами сильного основания и анионами слабой кислоты (CH3COONa, KCN, Ca(OCl)2, NaF и др.).
Соли этого типа за счет гидролиза в водных растворах имеют щелочную реакцию. Этот случай гидролиза называется гидролизом по аниону.
Пример 1. Написать молекулярное и ионное уравнение гидролиза ацетата натрия CH3COONa.
